题目内容
13.某地的酸雨中,含c (Na+)=7.0×10-6mol/L,c (Cl-)=4.5×10-5 mol/L,c (NH4+)=2.3×10-5 mol/L,c (SO42-)=2.5×10-6 mol/L,则该地酸雨的pH约为4.7.分析 根据溶液中电荷守恒计算该酸雨中氢离子浓度,再根据pH=-lgc(H+)计算出该溶液的pH.
解答 解:溶液中阴阳离子所带电荷相等,设氢离子浓度为c,所以c(NH4+)+c(Na+)+c(H+)=2×c (SO42-)+c(Cl-),
则:2.3×10-5mol/L+7.0×10-6mol/L+c(H+)=2×2.5×10-6mol/L+4.5×10-5mol/L,
解得:c(H+)=2×10-5mol/L,pH=5-lg2,lg2≈0.3,则pH≈5-0.3=4.7,
故答案为:4.7.
点评 本题考查了溶液pH的简单计算,题目难度不大,明确电荷守恒的含义及应用方法为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.(1)下表中有三组物质,每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液).
根据该表回答问题:
第Ⅲ组中有一种物质与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
第Ⅱ组物质中,跟第Ⅰ组所有物质都不能发生反应的是NaOH.
(2)双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN)化学方程式为:KCN+H2O2+H2O═KHCO3+A↑(已配平)①生成物A的化学式为NH3;②反应中被氧化的元素为C;③该反应中的氧化剂是H2O2.
(3)写出下列物质在水溶液里的电离方程式:硫酸铁Fe2(SO4)3=2Fe3++3SO42-,氯酸钾KClO3=K++ClO3-,NaHSO4在熔融状态下的电离方程式是NaHSO4=Na++HSO4-.
(4)下列说法中正确的是BD.
A.NaHSO4属于酸 B.NaHSO4属于酸式盐
C.NaHSO4溶液属于电解质 D.NaHSO4溶液能与Zn反应生成氢气
(5)Fe(OH)3胶体的制备方法在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热.
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Fe | NaOH | MgCl2 |
第Ⅲ组中有一种物质与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
第Ⅱ组物质中,跟第Ⅰ组所有物质都不能发生反应的是NaOH.
(2)双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN)化学方程式为:KCN+H2O2+H2O═KHCO3+A↑(已配平)①生成物A的化学式为NH3;②反应中被氧化的元素为C;③该反应中的氧化剂是H2O2.
(3)写出下列物质在水溶液里的电离方程式:硫酸铁Fe2(SO4)3=2Fe3++3SO42-,氯酸钾KClO3=K++ClO3-,NaHSO4在熔融状态下的电离方程式是NaHSO4=Na++HSO4-.
(4)下列说法中正确的是BD.
A.NaHSO4属于酸 B.NaHSO4属于酸式盐
C.NaHSO4溶液属于电解质 D.NaHSO4溶液能与Zn反应生成氢气
(5)Fe(OH)3胶体的制备方法在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热.
4.下列化学方程式不正确的是( )
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2 CH2OH+HBr$\stackrel{△}{→}$CH3CH2 CH2Br+H2O | |
| B. | 1-溴丙烷与氢氧化钠溶液共热:CH3CH2 CH2Br+NaOH$→_{△}^{水}$CH3CH2 CH2OH+NaBr | |
| C. | 苯酚钠中通入少量二氧化碳:2 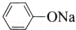 +CO2+H2O→2 +CO2+H2O→2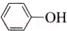 +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硫酸}$C6H12O6(果糖)+C6H12O6(葡萄糖) |
1.将pH=2的H2SO4a L与pH=11的NaOH b L混合后溶液pH=7,则a、b的比值为( )
| A. | 20:1 | B. | 1:20 | C. | 10:1 | D. | 1:10 |
18.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子 |
2.下列实验现象对应的结论正确的是( )


| 选项 | 现象 | 结论 |
| A | ①中导管口冒气泡,手松开无现象 | 气密性良 |
| B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
| C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
| D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 第2周期元素的第一电离能随原子序数递增依次增大 | |
| B. | 氟元素的电负性最大 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | CH2═CH2分子中共有四个σ键和一个π键 |
 .
.