题目内容
18.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子 |
分析 氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液.
A.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物;
B.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键;
C.用硝酸铜溶液代替硫酸铜溶液进行实验,反应本质相同,用硝酸铜溶液代替硫酸铜溶液进行实验,能观察到同样现象;
D.向硫酸铜溶液中加入氨水,氨水先和硫酸铜反应生成氢氧化铜蓝色沉淀,继续添加氨水,氨水和氢氧化铜反应生成可溶性的铜氨络合物.
解答 解:A.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,所以溶液中铜离子浓度减小,故A错误;
B.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对,故B错误;
C.用硝酸铜溶液代替硫酸铜溶液进行实验,本质都是形成[Cu(NH3)4]2+,能观察到同样现象,故C错误;
D.氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,难溶物溶解得到深蓝色的透明溶液,离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故D正确;
故选D.
点评 本题考查了配合物、配位键的形成等性质,题目难度中等,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体,注意配合物的形成过程原理的理解.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
9.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
10. R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
 R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | 原子半径由小到大的排序:Z、A、Y、X | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、A | |
| D. | RY3、A2X、ZA5分子中每个原子最外层都达到8 电子结构 |
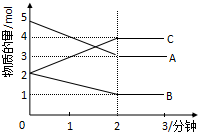 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.
 .
.
 .
.