题目内容
1.将pH=2的H2SO4a L与pH=11的NaOH b L混合后溶液pH=7,则a、b的比值为( )| A. | 20:1 | B. | 1:20 | C. | 10:1 | D. | 1:10 |
分析 pH=2的H2SO4溶液中c(H+)=0.01mol/L,pH=11的NaOH溶液中c(OH-)=10-3mol/L,两溶液混合后溶液pH=7,则n(H+)=n(OH-),再结合n=cV表示出n(H+)、n(OH-),据此列式计算.
解答 解:pH=2的H2SO4溶液中c(H+)=0.01mol/L,pH=11的NaOH溶液中c(OH-)=10-3mol/L,
混合后溶液pH=7,说明两溶液恰好中和,则n(H+)=n(OH-),故a×c(H+)=b×c(OH-),
所以a:b=c(OH-):c(H+)=10-3mol/L:0.01mol/L=1:10,
故选D.
点评 本题考查溶液pH的简单计算,题目难度不大,明确中和反应的实质为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
10.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 新制氯水:Na+、K+、NO${\;}_{3}^{-}$、NH3•H2O | |
| B. | 空气:CO、CO2、SO2、CH4 | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 浓高锰酸钾溶液;H+、Na+、SO${\;}_{4}^{2-}$、Cl- |
12.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:
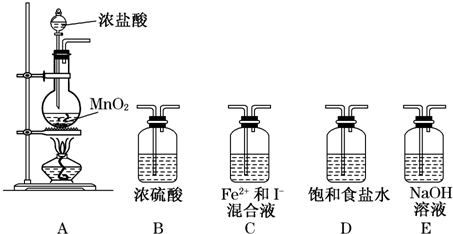
(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
(3)为了实验成功,必须控制各物质的量.该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液.为了验证上述假设,通入的Cl2体积最多不能超过0.112L(标准状况).
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:

(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分别置于A、B两试管中:往A中滴加KSCN溶液;往B中滴加淀粉溶液 | ①A中溶液变红,B中溶液不变蓝, 则假设1成立. ②A中溶液不变红,B中溶液变蓝, 则假设2成立. |
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
9.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
16.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
①检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽.
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
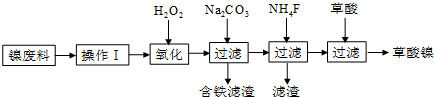
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下: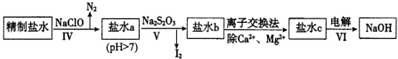
①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下:

①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
10. R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
 R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | 原子半径由小到大的排序:Z、A、Y、X | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、A | |
| D. | RY3、A2X、ZA5分子中每个原子最外层都达到8 电子结构 |

 .
.