题目内容
2.下列实验现象对应的结论正确的是( )
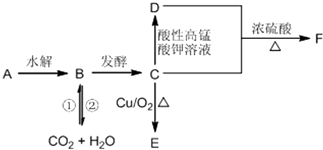
| 选项 | 现象 | 结论 |
| A | ①中导管口冒气泡,手松开无现象 | 气密性良 |
| B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
| C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
| D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.装置进行气密性检查时,如果导管口有气泡冒出,松开手导管内形成一段稳定的水柱,才能表示气密性良好;
B.②中KMnO4溶液紫红色褪去,二氧化硫表现了还原性,不是漂白性;
C.③中关闭K,气体颜色在热水中比冷水深,说明升高温度平衡向着生成二氧化氮的反应方向移动,则NO2生成N2O4为放热反应;
D.④中烧瓶中形成喷泉,说明形成了压强差,则Cl2易溶于CCl4.
解答 解:A.①中导管口冒气泡,松开手后形成一段水柱,说明气密性良好,若无现象,说明该装置的气密性不好,故A错误;
B.②中KMnO4溶液紫红色褪去,得出的结论应该是SO2有还原性,故B错误;
C.③中关闭K,气体颜色在热水中比冷水深,说明升高温度平衡向生成NO2 方向移动,所以NO2生成N2O4为放热反应,故C错误;
D.④烧瓶中形成喷泉,说明胶头滴管中的CCl4挤入烧瓶后能够使烧瓶产生压强差,因此也能得出结论Cl2易溶于CCl4,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及装置气密性检查、喷泉实验、二氧化硫的性质、化学平衡的影响因素等知识,试题知识点较多,充分考查学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
12.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:
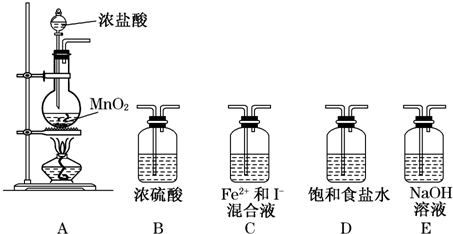
(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
(3)为了实验成功,必须控制各物质的量.该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液.为了验证上述假设,通入的Cl2体积最多不能超过0.112L(标准状况).
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:

(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分别置于A、B两试管中:往A中滴加KSCN溶液;往B中滴加淀粉溶液 | ①A中溶液变红,B中溶液不变蓝, 则假设1成立. ②A中溶液不变红,B中溶液变蓝, 则假设2成立. |
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
10. R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
 R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | 原子半径由小到大的排序:Z、A、Y、X | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、A | |
| D. | RY3、A2X、ZA5分子中每个原子最外层都达到8 电子结构 |
17.下列说法错误的是( )
| A. | 食物放在冰箱中会减慢食物变质的速率 | |
| B. | 钾的金属性强,所以钾与水的反应比钠的反应剧烈 | |
| C. | 2mol SO2与1mol O2混合反应后一定能生成2 mol SO3 | |
| D. | 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸 |
 .
.