题目内容
5.常温下分别将4块形状相同,质量为2.8g的铁块同时投入到下列四种溶液中,铁块首先完全溶解的是( )| A. | 150 mL 1 mol/L盐酸 | B. | 20 mL 18.4 mol/L硫酸 | ||
| C. | 50 mL 3 mol/L盐酸 | D. | 250 mL 2 mol/L硫酸 |
分析 氢离子浓度越大,Fe溶解的越快,但18.4 mol/L硫酸为浓硫酸,与Fe发生钝化,以此来解答.
解答 解:B中与Fe发生钝化,生成致密的氧化膜阻止反应的进一步发生,则Fe溶解最慢,
A、C、D中氢离子浓度为D(4mol/L)>C(3mol/L)>A(1mol/L),
则D中铁块首先完全溶解,
故选D.
点评 本题考查Fe的性质及反应速率,为高频考点,把握氢离子浓度与溶解速率的关系为解答的关键,侧重分析与应用能力的考查,注意B中发生钝化,题目难度不大.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
16.25℃时,将pH=8的NaOH溶液和pH=10的Ba(OH)2溶液等体积混合,若忽略混合过程的体积变化,则混合液的pH约为( )
| A. | 8.3 | B. | 8.7 | C. | 9.3 | D. | 9.7 |
17.原子序数依次增大的短周期元素a、b、c、d,它们的最外层电子数分别为1、5、6、1.a-的电子层结构与氦相同,b和c的次外层电子数与电子层数相同,c2-和d+的电子层结构相同.下列叙述错误的是( )
| A. | 元素b、c的离子半径大小为:c<b | |
| B. | a和b、c均能形成电子数为18的分子 | |
| C. | 元素a、b、c各自最高和最低化合价的代数和分别为0、2、4 | |
| D. | d和其他3种元素均能形成离子化合物 |
14.用石墨电极电解下列溶液,阴极和阳极产生气体的体积比为2:1,其电解液pH不变的是( )
| A. | NaCl | B. | H2SO4 | C. | NaOH | D. | K2SO4 |
15.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2,通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )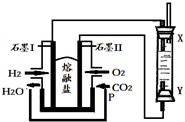

| A. | X、Y两端都必须用铁作电极 | B. | 不可以用NaOH溶液作为电解液 | ||
| C. | 阴极发生的反应是:2H++2e-=H2↑ | D. | 白色沉淀只能在阳极上产生 |

 .
.