题目内容
10.1体积某有机物蒸气与4体积氧气恰好反应,生成二氧化碳和水,反应后混合气体的密度比反应前的密度减小了$\frac{1}{6}$(气体体积都在150℃、1.01×105Pa时测定).此有机物的分子式是( )| A. | C3H8 | B. | C3H8O2 | C. | C2H6O | D. | C3H6O |
分析 设烃及烃的含氧衍生物组成通式为CxHyOz,完全燃烧通式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\stackrel{燃烧}{→}$xCO2+$\frac{y}{2}$H2O,150℃、1.01×105Pa时,生成的水为气体,反应前后混合气体总质量不变,而反应后混合气体的密度比反应前的密度减小了$\frac{1}{6}$,故反应后密度为反应前的$\frac{5}{6}$,则反应后气体总体积为反应前的$\frac{6}{5}$倍,结合消耗氧气体积列方程,联立可得x、y关系式,结合选项判断.
解答 解:设烃及烃的含氧衍生物组成通式为CxHyOz,完全燃烧通式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\stackrel{燃烧}{→}$xCO2+$\frac{y}{2}$H2O,由于1体积某有机物蒸气与4体积氧气恰好反应,则(x+$\frac{y}{4}$-$\frac{z}{2}$)=4,
150℃、1.01×105Pa时,生成的水为气体,反应前后混合气体总质量不变,而反应后混合气体的密度比反应前的密度减小了$\frac{1}{6}$,故反应后密度为反应前的$\frac{5}{6}$,则反应后气体总体积为反应前的$\frac{6}{5}$倍,故x+$\frac{y}{2}$=$\frac{6}{5}$×(1+4)=6,选项中C3H6O符合,
故选:D.
点评 本题考查化学方程式计算、有机物分子式确定,注意利用烃及烃的含氧衍生物燃烧通式解答.

练习册系列答案
相关题目
20.根据表中八种短周期元素的有关信息判断,下列说法错误的是( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/mn | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | 元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
1.下列做法正确的是( )
| A. | 将浓硝酸保存在无色玻璃瓶中 | |
| B. | 金属钠和钾保存在煤油中 | |
| C. | Na2CO3可以保存在玻璃塞的玻璃瓶中 | |
| D. | NaOH固体放在滤纸上称量 |
18.下表是不同温度下水的离子积常数:
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11,此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀_此空删去其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-_.
(4)含有Cr2O${\;}_{7}^{2-}$的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O${\;}_{7}^{2-}$.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.欲使10L该废水中的Cr2O${\;}_{7}^{2-}$完全转化为
Cr3+,则理论上需要加入83.4 g FeSO4•7H2O.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6 mol•L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11,此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀_此空删去其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-_.
(4)含有Cr2O${\;}_{7}^{2-}$的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O${\;}_{7}^{2-}$.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.欲使10L该废水中的Cr2O${\;}_{7}^{2-}$完全转化为
Cr3+,则理论上需要加入83.4 g FeSO4•7H2O.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6 mol•L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
5.如图所示的实验操作中,正确的是( )
| A. |  检查容器瓶是否漏水 | B. |  给溶液加热 | ||
| C. |  滴加液体 | D. |  过滤 |
15.实验室制取少量干燥的氨气涉及下列装置中,其中正确的是( )
| A. | 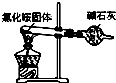 如图是氨气发生装置 | B. | 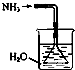 如图是氨气吸收装置 | ||
| C. | 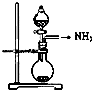 如图是氨气发生装置 | D. | 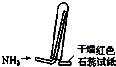 如图是氨气收集、检验装置 |
2.下列实验操作或事故处理正确的是( )
| A. | 分液时,打开分液漏斗旋转活塞,先放出下层液体,再放出上层液体 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 皮肤不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 过滤时,为了加快速度,用玻璃棒搅拌悬浊液 |
19.久置空气中不会因氧化还原反应而变质的物质是( )
| A. | 亚硫酸 | B. | 氯水 | C. | 氯化亚铁 | D. | 烧碱 |
 .
.