题目内容
15.如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )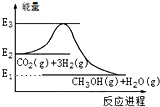
| A. | E2_E1是该反应的热效应 | |
| B. | E3_E1是该反应的热效应 | |
| C. | 该反应放热,在常温常压下就能进行 | |
| D. | 实现变废为宝,且有效控制温室效应 |
分析 A、根据化学反应的焓变等于反应物和产物的能量之差来回答;
B、根据化学反应的焓变等于反应物和产物的能量之差来回答;
C、根据反应物和产物能量的高低来确定反应的吸放热情况;
D、二氧化碳是温室气体,甲醇可以做燃料,据此回答.
解答 解:A、化学反应的热效应等于反应物和产物的能量之差,反应反应物的能量高于产物能量,所以反应放热,所以反应的热效应是E1_E2,故A错误;
B、化学反应的热效应等于反应物和产物的能量之差,所以反应的热效应是E1_E2,故B错误;
C、该反应反应物的能量高于产物能量,所以反应放热,但是放热反应在常温常压下不一定就能进行,故C错误;
D、二氧化碳是温室气体,甲醇可以做燃料,二氧化碳和氢气转化为甲醇和水的反应可以反应可以实现变废为宝,且有效控制温室,故D正确.
故选D.
点评 本题考查学生反应热的判断和计算知识,注意图象内容的理解和把握是关键,难度中等.

练习册系列答案
相关题目
5.下列事实可以用同一原理解释的是( )
| A. | 乙烯使溴水、高锰酸钾溶液褪色 | |
| B. | 碘片、氯化铵晶体受热消失 | |
| C. | 二氧化硫和氯气使品红溶液褪色 | |
| D. | 乙醛、葡萄糖与银氨溶液水浴加热反应 |
6.常温下,两种酸的电离平衡常数如下表:
常温下,浓度均为0.1mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是( )
| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A. | pH:Na2CO3溶液小于Na2SO3溶液 | |
| B. | 结合H+能力:CO32-弱于SO32- | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | ①与②溶液等体积混合后的溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-) |
3.下列关于自然界中氮循环示意图(如图)的说法错误的是( )

| A. | 氮元素只被氧化 | |
| B. | 豆科植物根瘤菌固氮属于自然固氮 | |
| C. | 其它元素也参与了氮循环 | |
| D. | 含氮无机物和含氮有机物可相互转化 |
10. 某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
 某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )| A. | H2SO4浓度为4mol/L | B. | 溶液中最终溶质为FeSO4 | ||
| C. | 原混合酸中NO3-浓度为0.2mol/L | D. | AB段反应为:Fe+2Fe3+→3Fe2+ |
7.已知,NO2和溴蒸汽都是红棕色气体,且都有强氧化性.在加压条件下,NO2可以发生如下反应:2NO2(g)?N2O4(g).下列试剂或方法中不能降NO2和溴蒸气区别开的是( )
| A. | 向两种气体中加入适量水,震荡 | B. | 将两种气体分别通入AgNO3溶液中 | ||
| C. | 用湿润的淀粉KI试纸检验 | D. | 将两种气体加压、冷却 |
4.标准状况下,112ml,某气体的质量为0.29g,该气体的摩尔质量约为( )
| A. | 29g•mol-1 | B. | 29g | C. | 58g•mol-1 | D. | 58g |
17.常温下,将0.1000mol•L-1NaOH溶液滴入20.0mL0.1000mol•L-1的一元酸HA溶液中,测得混合溶液的PH变化曲线如图所示,下列说法正确的是( )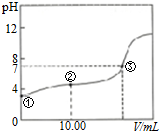

| A. | 两溶液反应的离子方程式是H++OH-+H2O | |
| B. | 图中②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| C. | 图中②点所示溶液中:c(A-)>c(H+)>c(HA)>c(OH-) | |
| D. | 图中③点所示滴入的NaOH溶液的体积V=20.00mL |