题目内容
14.有机物在生产生活中扮演着重要的角色,研究有机物具有重要的意义.【资料】乙烯的比例模型如图1所示.实验测得乙烯中碳碳双键的键能(键能是指断开1mol化学键所需的能量)是615kJ/mol,乙烷中碳碳单键的键能是348kJ/mol.只需要较少的能量,就能使双键里较弱的一个键断裂,这是乙烯的化学性质较活泼,容易发生加成反应等的原因.常温下乙烯易被 氧化剂氧化,如将乙烯通入酸性KMn04溶液,溶液的紫色褪去,乙烯被氧化为二氧化碳.
Ⅰ.参考上述资料,结合已学知识,回答下列问题.
(1)乙烯的结构式是
 .
.(2)下列说法中不正确的是bd(填序号)
a.氯乙烯(CH2=CHCl)中六个原子在同一个平面上
b.乙稀分子中的碳碳双键是两条相同的碳碳单键
c.长途运输水果时,可用酸性高锰酸钾溶液吸收水果释放的乙烯,以保持水果新鲜
d.除去乙烷中的乙烯,可以选用酸性高锰酸钾溶液
(3)实验室制取的乙烯中混有S02等气体杂质.下列试剂中,可用于检验乙烯中混有的SO2的是c(填序号)
a.溴水 b.酸性高锰酸钾溶液 c.品红溶液.
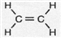
Ⅱ.已知乙烯能发生如图2转化
(1)D物质所含官能团的名称是羧基.
(2)反应②(B-C)的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 I.(1)乙烯的分子式为C2H4,碳原子之间形成C=C双键;
(2)a.一氯乙烯(CH2=CHCl)为平面结构,所有原子都在同一平面内;
b.根据碳碳双键与碳碳单键的键能分析解答;
c.高锰酸钾溶液可以氧化乙烯;
d.乙烯被酸性高锰酸钾溶液氧化得到二氧化碳,会引入新杂质;
(3)溴水、酸性高锰酸钾溶液均能与乙烯、二氧化硫反应,用品红溶液进行检验二氧化硫;
Ⅱ.乙烯与是发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醇与D反应得到乙酸乙酯,则D为CH3COOH,乙烯发生加聚反应生成聚乙烯.
解答 解:I.(1)乙烯的分子式为C2H4,碳原子之间形成C=C双键,聚乙烯结构式为: ,故答案为:
,故答案为: ;
;
(2)a.一氯乙烯(CH2=CHCl)为平面结构,所有原子都在同一平面内,故a正确;
b.乙烯中碳碳双键的键能是615kJ/mol,乙烷中碳碳单键的键能是348kJ/mol,故乙烯分子中的碳碳双键不是两条相同的碳碳单键,故b错误;
c.乙烯可以催熟水果,高锰酸钾溶液可以氧化乙烯,以保持水果新鲜,故c正确;
d.乙烯被酸性高锰酸钾溶液氧化得到二氧化碳,会引入新杂质,故d错误,
故答案为:bd;
(3)溴水、酸性高锰酸钾溶液均能与乙烯、二氧化硫反应,不能检验混有的二氧化硫,用品红溶液进行检验二氧化硫,
故答案为:c;
II.乙烯与是发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醇与D反应得到乙酸乙酯,则D为CH3COOH,乙烯发生加聚反应生成聚乙烯.
(1)D为CH3COOH,所含官能团的名称是羧基,故答案为:羧基;
(2)反应②(B-C)的化学方程式是:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查有机物推断、乙烯的结构与性质等,为高频考点,侧重于学生的分析能力的考查,难度不大,注意对基础知识的理解掌握.

 名校课堂系列答案
名校课堂系列答案| A. | 铝热剂就是单指Fe2O3 粉和铝粉 | |
| B. | 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 分别还原1mol Fe2O3所需H2、Al、CO 的物质的量之比3:2:3 | |
| D. | Fe2O3和Fe3O4都是具有磁性 |

| A. | 仅由其核磁共振氢谱可知其分子中的氢原子总数由红外光谱可知,该有机物中至少含有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3 | |
| C. | 若A的化学式为C3H6O2,则其结构简式为CH3COOCH3 | |
| D. | 若A的化学式为C3H6O2,则其可能的结构有三种 |
 图表归纳是学习化学的一种常用方法,某同学归纳的下表中的物质及其所属类別与图的对应关系正确的是( )
图表归纳是学习化学的一种常用方法,某同学归纳的下表中的物质及其所属类別与图的对应关系正确的是( )| 选项 | X | Y | Z |
| A | 胶体 | 混合物 | 淀粉溶液 |
| B | 化合物 | 酸性氧化物 | 一氧化氮 |
| C | 气态氢化物 | 化合物 | 液溴 |
| D | 强电解质 | 强酸 | 硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | H3O+ | B. | H2O | C. | NO2+ | D. | NO2- |


