题目内容
9.某探究小组拟在实验室用如图所示装置和药品制取气体:
请回答下列问题:
(1)A装置中收集气体的仪器名称是集气瓶.
(2)能够实现气体发生和收集的正确装置是C.该装置中制气体的反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)B、D装置中不能使用浓盐酸的原因是浓盐酸具有挥发性,会导致制取的气体不纯
(4)乙炔(C2H2)又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔.你认为通过更换药品可以选用来制取乙炔的制取装置是A和D;乙炔燃烧的化学方程式为2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
分析 (1)根据仪器图形可知收集气体的仪器为集气瓶;
(2)A、B、C、D收集气体分别为二氧化碳、氢气、氧气、二氧化碳,结合气体的密度判断收集方法;
(3)浓盐酸具有挥发性,混有氯化氢;
(4)乙炔密度比空气小,用向下排空法收集.
解答 解:(1)稀硫酸与氢氧化钠固体反应,生成的气体是二氧化碳,用集气瓶收集,故答案为:集气瓶;
(2)A中生成的气体是二氧化碳,不可用向下排空气法收集,所以图中收集方法不正确;B中锌粒与稀盐酸反应,生成的气体是氢气,应该用向下排空气法收集,所以收集的方法不正确;C中的双氧水和二氧化锰反应生成的气体是氧气,应该用向上排空气法收集,收集方法正确,反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:C;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)浓盐酸具有挥发性,生成的气体易混有氯化氢,故答案为:浓盐酸具有挥发性,会导致制取的气体不纯;
(4)乙炔密度比空气小,用向下排空法收集,可用A、D装置,乙炔燃烧的化学方程式为2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,
故答案为:A和D;2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
点评 本题考查气体的制备实验,为高频考点,侧重于学生的分析、实验能力的考查,注意把握实验的原理以及物质的性质,难度不大.

练习册系列答案
相关题目
19.常温下取pH均等于1的硫酸和醋酸各10ml,分别稀释10倍后,再分别加入0.07g锌粉充分反应,有关叙述正确的是( )
| A. | 硫酸和醋酸反应时放出氢气一样多 | B. | 反应后醋酸溶液中锌粉有剩余 | ||
| C. | 稀释后溶液中的c(H+)硫酸比醋酸大 | D. | 反应开始时醋酸中的反应速率大 |
17.在病人的尿液中,加入新制氢氧化铜乳浊液共热,如果有红色沉淀生成,说明在病人的尿液中含有( )
| A. | 尿素 | B. | 乙醇 | C. | 乙酸 | D. | 葡萄糖 |
4.下列有关1mol CO2的说法,正确的是( )
| A. | 质量为12 g | |
| B. | 体积为22.4 L | |
| C. | 二氧化碳分子个数约为6.02×1023个 | |
| D. | 氧原子个数约为6.02×1023个 |
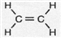
1.组成和结构可用 表示的有机物,能在一定条件下发生消去反应的共有( )
表示的有机物,能在一定条件下发生消去反应的共有( )
 表示的有机物,能在一定条件下发生消去反应的共有( )
表示的有机物,能在一定条件下发生消去反应的共有( )| A. | 5 种 | B. | 10种 | C. | 20 种 | D. | 30种 |
18.在一定条件下,对于密闭容器中进行的可逆反应:2HI(g)?H2 (g)+I2 (g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
| A. | HI、H2、I2的浓度相等 | B. | HI、H2、I2的浓度不再发生变化 | ||
| C. | HI、H2、I2在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于零 |
18.工业上常用电解法冶炼的金属是( )
| A. | 钠 | B. | 铁 | C. | 铜 | D. | 银 |
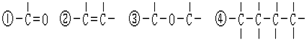
 .
.