题目内容
4.铝原子的原子序数是13;单质铝常温下是一种银白色的金属,密度小熔点较低.分析 铝的原子序数为13,位于周期表第三周期ⅢA族,具有金属的通性,熔点低,密度小,以此解答.
解答 解:铝的原子序数为13,单质铝常温下是一种银白色的金属,密度小,熔点较低,
故答案为:13;银白;小;低.
点评 本题考查铝的性质,为高频考点,侧重于双基的考查,注意把握常见金属的性质与应用,题目有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
15.某强酸性溶液X可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
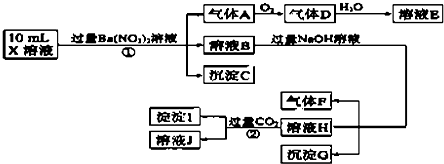
测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,沉淀C物质的量小于0.7mol,根据以上信息,下列说法正确的是( )

测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,沉淀C物质的量小于0.7mol,根据以上信息,下列说法正确的是( )
| A. | 由实验①可知,气体A一定是NO,沉淀C一定是BaSO4,原溶液中肯定含有SO32- | |
| B. | 溶液E和气体F不能发生化学反应 | |
| C. | 由实验 ②可知,沉淀I可能是Al(OH)3和BaCO3 | |
| D. | 原溶液中肯定含有Al3+、NH4+、Fe2+、SO42-、Cl-,不能确定是否含有Fe3+ |
19.常温下取pH均等于1的硫酸和醋酸各10ml,分别稀释10倍后,再分别加入0.07g锌粉充分反应,有关叙述正确的是( )
| A. | 硫酸和醋酸反应时放出氢气一样多 | B. | 反应后醋酸溶液中锌粉有剩余 | ||
| C. | 稀释后溶液中的c(H+)硫酸比醋酸大 | D. | 反应开始时醋酸中的反应速率大 |
9.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+ | B. | 原子半径:Na<Mg<Al | ||
| C. | 离子的氧化性:Na+>Mg2+>Al3+ | D. | 单质的还原性:Na<Mg<Al |
13.我国报道的高温超导体中,铊是组成成分之一.已知铊和铝是同族元素,关于铊的判断错误的是( )
| A. | 铊是银白色的金属 | B. | 能置换出盐酸中氢离子 | ||
| C. | 能生成+3价的化合物 | D. | 氢氧化铊是两性氢氧化物 |
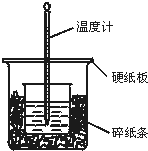 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
 .
.