题目内容
7.如图所示,在101kPa时,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )
| A. | 石墨的燃烧热为393.5kJ/mol | |
| B. | 石墨转变成金刚石需要吸收能量,是物理变化 | |
| C. | 石墨比金刚石稳定 | |
| D. | 1mol金刚石与1molO2的总能量低于1molCO2的总能量 |
分析 先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定来解答.
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,石墨的燃烧热为393.5kJ/mol,故A正确;
B、石墨转化为金刚石吸热,是化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质能量越大越不稳定,则石墨比金刚石稳定,故C正确;
D、由图可知金刚石燃烧的热化学方程式为:C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,故D错误;
故选:AC.
点评 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
17.下列过程或现象与盐类水解有关的是( )
| A. | NaHSO4溶液呈酸性 | B. | NaHCO3与盐酸混合产生CO2气体 | ||
| C. | Na2CO3溶液加热后去污能力增强 | D. | NaHSO3能使酸性KMnO4溶液褪色 |
18.下列微粒在溶液中能大量共存的是( )
| A. | NH4+、Mg2+、SO42-、CH3COO- | B. | HCO3-、K+、Cl-、AlO2- | ||
| C. | Cu2+、Na+、SO42-、HS- | D. | Na+、H+、SO42-、S2O32- |
2.下列有机物的结构简式和名称都正确的是( )
| A. | 2-甲基丁醛 CH3CH2 (CH3)CHCOH | B. | 硬酯酸甘油脂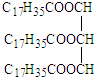 | ||
| C. | TNT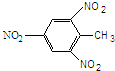 | D. | α-氨基丙酸 CH3CH(NH2)COOH |
12.工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2FeO4+Na2O,下列说法正确的是( )
| A. | 反应中Fe2O3是还原剂 | |
| B. | Fe2O3可以通过铁丝在氧气中燃烧制得 | |
| C. | 3molNa2O2反应,有3mol电子转移 | |
| D. | 在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
19.铁铝矾[Al2Fe(SO4)4•xH2O]有净水作用,将其溶于水中得到浅绿色溶液,有关该溶液的叙述正确的是( )
| A. | 该溶液显中性 | |
| B. | 该溶液中:2 c(Al3+)+c(Fe2+)+c(H+ )=4 c(SO42-)+c(OH-) | |
| C. | 在空气中蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 | |
| D. | 向该溶液中加入Ba(OH)2溶液,当SO42-完全沉淀时,Al3+、Fe2+恰好被完全沉淀 |
16.下列说法正确的是( )
| A. | 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度 | |
| B. | 在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05mol•L-1下降到0.03 mol•L-1,该双氧水在这2h中分解的平均反应速率约为0.015 mol•L-1•h-1 | |
| C. | 其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢 | |
| D. | 一定条件下,固定体积的容器中发生反应A(g)+B(g)?2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应一定处于平衡状态 |