题目内容
10.下列溶液中微粒浓度关系一定正确的是( )| A. | pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 | |
| B. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] | |
| C. | pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 | |
| D. | 0.10 mol•L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
分析 A.氨水为弱碱,混合液中氨水过量,溶液呈碱性;
B.氯气溶于水,只有部分氯气与水反应,则氯水中仍然存在大量的氯气分子;
C.氨水为弱碱,稀释后期电离程度增大,则稀释后氨水中氢氧根离子浓度大于氢氧化钠;
D.根据碳酸钠溶液中的电荷守恒判断.
解答 解:A.pH=4的盐酸与pH=10的氨水溶液等体积混合后,氨水为弱碱,则混合液中氨水过量,混合液呈碱性,溶液的pH>7,故A正确;
B.氯水中存在未参与反应的氯气,则c(Cl2)≠2[c(ClO-)+c(Cl-)+c(HClO)],故B错误;
C.pH=11的NaOH和pH=11的氨水分别稀释100倍,由于氨水的电离程度增大,则稀释后氨水中氢氧根离子浓度较大,所以pH前者一定小于后者,故C错误;
D.0.10mol•L-1Na2CO3溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较、溶液pH的计算,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意掌握电荷守恒的含义及应用方法,B为易错点,注意氯水中还存在大量氯气.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20. 2011国际化学年,为纪念瑞士化学家Reichstein 1933年首先合成维生素C,瑞士发行了一枚印有Vc分子(C6H8O6)的3D效果邮票(如右图,图中小短棍可表示单键、双键或叁键).下列关于Vc说法正确的是( )
2011国际化学年,为纪念瑞士化学家Reichstein 1933年首先合成维生素C,瑞士发行了一枚印有Vc分子(C6H8O6)的3D效果邮票(如右图,图中小短棍可表示单键、双键或叁键).下列关于Vc说法正确的是( )
 2011国际化学年,为纪念瑞士化学家Reichstein 1933年首先合成维生素C,瑞士发行了一枚印有Vc分子(C6H8O6)的3D效果邮票(如右图,图中小短棍可表示单键、双键或叁键).下列关于Vc说法正确的是( )
2011国际化学年,为纪念瑞士化学家Reichstein 1933年首先合成维生素C,瑞士发行了一枚印有Vc分子(C6H8O6)的3D效果邮票(如右图,图中小短棍可表示单键、双键或叁键).下列关于Vc说法正确的是( )| A. | 维生素C结构中包含了一个五元碳环 | |
| B. | 从结构来看,维生素C不溶于水 | |
| C. | 维生素C具有羟基和酯基两种官能团 | |
| D. | 维生素C能与氢气、溴水、氢氧化钠溶液等发生反应 |
1.在下列条件下,两种气体的分子数一定相等的是( )
| A. | 同温度,同体积的N2和O2 | B. | 同质量,不同密度的N2和CO | ||
| C. | 同压强,同体积的H2和CH4? | D. | 同体积,同密度的CO2和N2 |
18.下列微粒在溶液中能大量共存的是( )
| A. | NH4+、Mg2+、SO42-、CH3COO- | B. | HCO3-、K+、Cl-、AlO2- | ||
| C. | Cu2+、Na+、SO42-、HS- | D. | Na+、H+、SO42-、S2O32- |
5.下列实验目的可以达到的是( )
| A. | 将滴有稀硫酸的淀粉溶液加热后,加入新制的Cu(OH)2悬浊液,加热,没有红色沉淀,说明淀粉在该条件下没有水解 | |
| B. | 将铜与足量的浓硝酸反应生成的气体干燥后收集,用冰水混合物冷却降温,研究温度对化学平衡的影响 | |
| C. | 将混合气体通过饱和Na2CO3溶液以便除去CO2中少量的SO2 | |
| D. | 某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
2.下列有机物的结构简式和名称都正确的是( )
| A. | 2-甲基丁醛 CH3CH2 (CH3)CHCOH | B. | 硬酯酸甘油脂 | ||
| C. | TNT | D. | α-氨基丙酸 CH3CH(NH2)COOH |
19.铁铝矾[Al2Fe(SO4)4•xH2O]有净水作用,将其溶于水中得到浅绿色溶液,有关该溶液的叙述正确的是( )
| A. | 该溶液显中性 | |
| B. | 该溶液中:2 c(Al3+)+c(Fe2+)+c(H+ )=4 c(SO42-)+c(OH-) | |
| C. | 在空气中蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 | |
| D. | 向该溶液中加入Ba(OH)2溶液,当SO42-完全沉淀时,Al3+、Fe2+恰好被完全沉淀 |
2.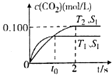 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
①T3时该反应的平衡常数K=0.5,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2,0.5molN2,则反应向逆(填“正”或“逆”)反应方向进行.
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)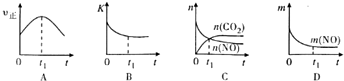
(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.
 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
| 容器编号 | 起始物质的量 | 平衡时物质的量 |
| Ⅰ | 2.0mol NO,2.0mol CO | 1.0mol CO2 |
| Ⅱ | 4.0mol NO,4.0mol CO |
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.