题目内容
7.处于金属和非金属分界线附近的元素常作催化剂错(判断对错)分析 在金属元素与非金属元素的分界线附近的元素,通常既具有金属性又具有非金属性,可以找到半导体材料.
解答 解:在元素周期表金属元素与非金属元素的分界线附近寻找的是半导体材料,而做催化剂的元素从过渡元素区寻找,所以该说法错误,
故答案为:错.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置及性质为解答的关键,注重基础知识的考查,题目难度不大

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度 | |
| B. | 在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05mol•L-1下降到0.03 mol•L-1,该双氧水在这2h中分解的平均反应速率约为0.015 mol•L-1•h-1 | |
| C. | 其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢 | |
| D. | 一定条件下,固定体积的容器中发生反应A(g)+B(g)?2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应一定处于平衡状态 |
13.在一定温度和压强下,2L气体XY2与1L气体Y2化合,生成2L气体化合物,则该化合物的化学式为( )
| A. | X3Y | B. | X3Y2 | C. | X2Y3 | D. | XY3 |
2.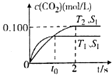 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
①T3时该反应的平衡常数K=0.5,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2,0.5molN2,则反应向逆(填“正”或“逆”)反应方向进行.
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)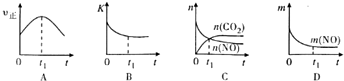
(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.
 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
| 容器编号 | 起始物质的量 | 平衡时物质的量 |
| Ⅰ | 2.0mol NO,2.0mol CO | 1.0mol CO2 |
| Ⅱ | 4.0mol NO,4.0mol CO |
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.
12.最简式相同,但既不是同系物又不是同分异构体的是( )
| A. | CH≡CH 和  | B. | 甲醚和乙醇 | C. | 环丙烷和环己烷 | D. |  和 和 |
16.镁铝性质相似,下表中对两者的对比不正确的是( )
| 选项 | 反应 | 铝 | 镁 |
| A | 与非金属 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
| B | 与水 | 能与沸水反应 | 反应很困难 |
| C | 与碱 | 能溶于强碱溶液 | 不反应 |
| D | 与某些氧化物 | 能与Fe2O3、MnO2、Cr2O3等 金属氧化物发生铝热反应 | 能在CO2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
17.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 在1mol甲基(-CH3)中,电子总数9NA | |
| B. | 在1mol的Na2O2中,有2NA个阴离子 | |
| C. | 标准状况下,22.4L CHC13所含有的分子数目为NA | |
| D. | Cu、A1为电极,浓硝酸为电解质溶液所构成的原电池中,导线上流过NA个电子,则A1电极放出气体的体积一定为22.4L |