题目内容
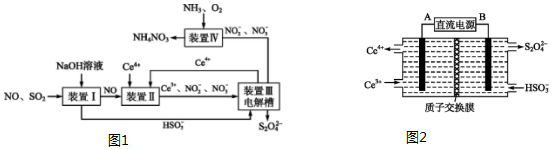
3.工业生产中产生的废气、废液、废渣直接排放会造成污染,很多都经过吸收转化为化工产品.I.利用电化学原理吸收工业生产中产生的SO2、NO,同时获得Na2S2O4和NH4NO3产品的工艺
流程图如图1(Ce为铈元素).
请回答下列问题:
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式:NO+H2O+Ce4+=Ce3++NO2-+2H+.
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示:右侧反应室中发生的主要电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol•L-1,要使1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为4480 L.
分析 装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-.
(1)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(2)生成Ce4+为氧化反应,发生在阳极上,反应物是HSO3-被还原成S2O42-,得到电子;
(3)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,设消耗标况下氧气的体积是V,结合电子守恒进行计算.
解答 解:(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(3)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:$\frac{VL}{22.4L/mol}$×4=1000×(5-3)×0.4mol,解得V=4480L,
故答案为:4480.
点评 本题考查电工业生产中化学原理吸收SO2和NO的工艺,为高频考点,侧重分析、计算能力的考查,题目涉及氧化还原反应、电化学等,综合性强,题目难度中等.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案| A. | K+、Cu2+、OH-、SO42- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Zn2+、NH4+、NO3+、Cl- | D. | K+、Na+、CO32-、SO42- |
| A. | 在KClO3+6HCl=3Cl2↑+KCl+3H2O中,被氧化的氯原子和被还原的氯原子的个数比为6:1 | |
| B. | 在反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,则被还原的元素为氮和硫 | |
| C. | 失电子能力难的原子获得电子的能力一定强 | |
| D. | 在化学反应中某元素由化合态变为游离态,该元素一定被还原了 |
| A. | 分子中含有两个氢原子的酸一定是二元酸 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | Na2O、Na2O2组成元素相同,与CO2反应产物相同 | |
| D. | 钢铁发生电化学腐蚀时,负极的电极反应式为Fe-3e-═Fe3+ |
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.3 mol/L | D. | 0.4mol/L |
| 选项 | 性质 | 实际应用 |
| A. | 生石灰具有吸水性 | 生石灰用作袋装食品的抗氧化剂 |
| B. | 碳酸钠能与盐酸反应 | 碳酸钠可用作治疗胃酸过多的药剂 |
| C. | 氢氟酸能与硅酸钠反应生成硅酸 | 氢氟酸可用于雕刻玻璃 |
| D. | Al2O3熔点非常高 | 氧化铝用作耐高温材料 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 煤的气化、液化和干馏的过程都没有涉及化学变化 | |
| B. | 石油分馏产品中重油进行催化裂化,可提高汽油等轻质油的产量和质量 | |
| C. | 天然气和沼气的主要成分相同,都是甲烷 | |
| D. | 氢气的热值比汽油高,是理想的清洁燃料和绿色能源 |




