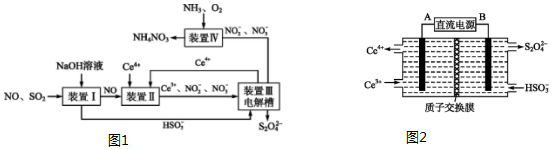
题目内容
11.下列关于氧化还原反应说法正确的是( )| A. | 在KClO3+6HCl=3Cl2↑+KCl+3H2O中,被氧化的氯原子和被还原的氯原子的个数比为6:1 | |
| B. | 在反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,则被还原的元素为氮和硫 | |
| C. | 失电子能力难的原子获得电子的能力一定强 | |
| D. | 在化学反应中某元素由化合态变为游离态,该元素一定被还原了 |
分析 A.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,根据化合价不交叉的原则,KClO3中+5价的氯元素降为0价,HCl中氯元素升为0价,氯化钾中的氯元素来自盐酸,不参加氧化还原反应;
B.化合价降低被还原;
C.稀有气体元素既不易失电子也不易得电子;
D.根据元素的化合价变化判断.
解答 解:A.KClO3中+5价的氯元素降为0价,该氯原子为被还原的氯原子,HCl中氯元素升为0价,该氯原子为被氧化的氯原子,氯化钾中的氯元素来自盐酸,氯化钾的计量数为1,生成氯化钾需要盐酸的计量数为1,所以被氧化的氯原子与被还原的氯原子的原子个数比是5:1,故A错误;
B.在反应:2KNO3+3C+S=K2S+N2↑+3CO2↑中N、S元素的化合价都发生了降低,则被还原的元素为氮和硫,故B正确;
C.稀有气体元素既不易失电子也不易得电子,所以失电子能力难的原子获得电子的能力不一定强,故C错误;
D.在化学反应中某元素由化合态变为游离态,如S2-变为S,元素的化合价升高,被氧化,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念和物质的性质,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.氮及其化合物在生产生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
①试判断K2K1<(填写“>”“=”或“<”)②在298K时,下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
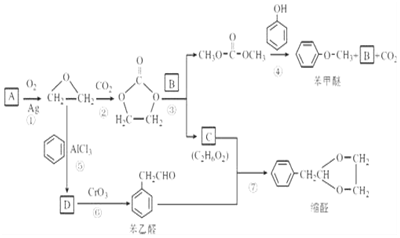
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.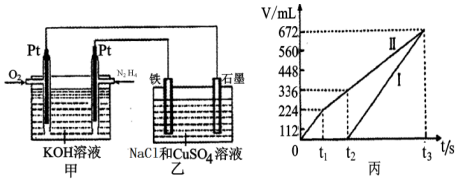
①该燃料电池的负极反应式为;N2H4+4OH--4e-=N2↑+4H2O,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为0.2mol/L.③在t2时所得溶液的pH为0.7.(假设溶液体积不变,保留一位小数,lg2=0.3)
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.

①该燃料电池的负极反应式为;N2H4+4OH--4e-=N2↑+4H2O,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为0.2mol/L.③在t2时所得溶液的pH为0.7.(假设溶液体积不变,保留一位小数,lg2=0.3)
19.二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
回答下列问题:
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H,该反应△H=-263 kJ•mol-1,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示);
(2)下列措施中,能提高CH3OCH3产率的有AD;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(3)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(4)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD;
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
(5)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H,该反应△H=-263 kJ•mol-1,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示);
(2)下列措施中,能提高CH3OCH3产率的有AD;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(3)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(4)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD;
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%

(5)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.
16.下列说法与胶体有关且正确的是( )
| A. | 食盐水不会发生丁达尔效应 | |
| B. | 稀豆浆能通过半透膜 | |
| C. | 用氢氧化铁胶体进行电泳实验时,阴极(与电源负极相连)附近顔色加深,说明氢氧化铁胶体带正电 | |
| D. | 将装有淀粉溶液的半透膜袋浸入蒸馏水中,一段时间后往蒸馏水中滴入碘液,不变蓝 |
20.一定量的Fe与过量的稀硫酸反应制取氢气,一定温度下为加快反应速率而又不影响氢气的量,可向其中加入( )
| A. | KCl晶体 | B. | Zn粉 | C. | SO3固体 | D. | CuSO4晶体 |
1.对下列溶液的说法正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 浓度均为0.1 mol/L的四种溶液中由水电离出的H+浓度由大到小的顺序是:氯化铵、醋酸、硫酸、氢氧化钠 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-和CrO42-,浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先沉淀 | |
| D. | 25℃时,取0.2mol•L-1 HClO溶液与0.2mol•L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(ClO-)=9.9×10-7mol•L-1 |
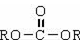 $\stackrel{2R′OH}{→}$2ROH+
$\stackrel{2R′OH}{→}$2ROH+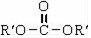
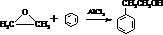 .
. 、
、 .
. 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备 的合成路线(须注明必要的反应条件)
的合成路线(须注明必要的反应条件)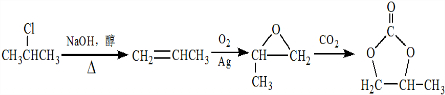 .
.