题目内容
16.下列A~H八种物质存在如下图所示的转化关系(反应条件、部分产物未标出).已知A是酸式盐,B能使品红溶液褪色,G是红棕色气体,D和H是同一类物质.
试回答下列问题:
(1)写出下列各物质的化学式:ANH4HSO3、HHNO3.
(2)按要求写出下列反应的有关方程式
①A→E反应的离子方程式NH4++HSO3-+2OH-=NH3•H2O+SO32-+H2O;
②E→F 反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)常温下可以用铝制容器盛装浓D,是因为铝能被浓硫酸钝化,将铁粉逐渐加入100ml浓H中直至过量,按先后顺序写出所发生反应的离子方程式:3NO3-+Fe+6H+═Fe3++3NO2↑+3H2O、2Fe3++Fe=3Fe2+.
分析 G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO;A是酸式盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;二氧化氮和水反应后能生成F和H,是和水反应生成硝酸和NO,所以H是HNO3;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为硫酸,A是酸式盐,反应后能生成二氧化硫,所以A是NH4HSO3,据此解答.
解答 解:G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO;A是酸式盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;二氧化氮和水反应后能生成F和H,是和水反应生成硝酸和NO,所以H是HNO3;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为硫酸,A是酸式盐,反应后能生成二氧化硫,所以A是NH4HSO3,
(1)根据上面的分析可知,A是NH4HSO3,H是HNO3,
故答案为:NH4HSO3;HNO3;
(2)①A→E反应的离子方程式为NH4++HSO3-+2OH-=NH3•H2O+SO32-+H2O,②E→F 反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NH4++HSO3-+2OH-=NH3•H2O+SO32-+H2O;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)D为硫酸,常温下可以用铝制容器盛装浓硫酸,是因为铝能被浓硫酸钝化,H是HNO3,将铁粉逐渐加入100ml浓HNO3中直至过量,按先后顺序写出所发生反应的离子方程式为3NO3-+Fe+6H+═Fe3++3NO2↑+3H2O、2Fe3++Fe=3Fe2+,
故答案为:铝能被浓硫酸钝化;3NO3-+Fe+6H+═Fe3++3NO2↑+3H2O、2Fe3++Fe=3Fe2+.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,涉及N、S元素化合物性质及相互转化,物质的颜色是推断突破口,结合元素化合物的性质来分析解答即可,难度中等.

| A. | Al3+、ClO-、Cl- | B. | Na+、NH4+、Cl- | C. | Mg2+、Cl-、Fe2+ | D. | Mg2+、Ba2+、Br- |
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 4:3 |
| A. | 按系统命名法,化合物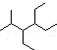 的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 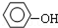 与 与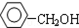 互为同系物 互为同系物 |
| A. | 光照下2,2-二甲基丙烷与Br2反应其二溴取代物有两种 | |
| B. | 1mol C4HmO完全燃烧,最多消耗O2为6mol | |
| C. | FeCl3溶液可以把5种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液、氢硫酸一一区分 | |
| D. | 分子式CF2Cl2、C3H6、C2H4、C2H2均只对应一种化合物 |
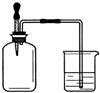 如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )①CO、O2 ②Cl2、NH3 ③NO2、O2 ④N2、H2.
| A. | ①② | B. | ②④ | C. | ②③ | D. | ③④ |
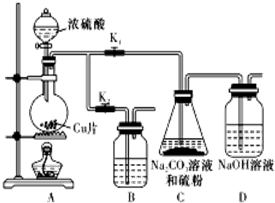 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
Ⅰ.打开Kl,并闭K2,向圆底烧瓶中加人足量浓硫酸,加热.
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①I中,圆底烧瓶中发生反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅳ中将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯.
④装置B的作用是在C中的反应停止后吸收A中产生的多余SO2防止空气污染.
(2)依据反应2S2O32-+I2═S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol•L-1I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是90.2%(Na2S2O3•5H2O的式量为248,计算结果保留1位小数).
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2. 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.