题目内容
11.把一定量铁粉放入硫酸铁溶液中,完全反应后,所得溶液中Fe2+的浓度是Fe3+的浓度的2倍,则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 4:3 |
分析 铁粉放入硫酸铁溶液中发生反应生成硫酸亚铁,根据方程式设反应的三价铁的量,就可以获得生成的亚铁的量,进而获得未反应的Fe3+的物质的量,二者之比即为答案.
解答 解:铁粉放入三氯化铁溶液中,发生的反应为:Fe+2Fe3+=3Fe2+,已反应的Fe3+的物质的量为n,则
Fe+2Fe3+=3Fe2+
2 3
n 1.5n
溶液中的Fe3+和Fe2+浓度之比为1:2,所以,未反应的Fe3+的物质的量为$\frac{3}{4}$n,所以已反应的Fe3+和未反应的Fe3+的物质的量之比=n:$\frac{3}{4}$n=4:3,
故选D.
点评 本题是一道关于三价铁和亚铁之间相互转化的题目,要求学生学会利用化学方程式表达题目已知条件,难度不大.

练习册系列答案
相关题目
1.在中学化学教材后所附的周期表中,若甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列有关判断中正确的是( )
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其它周期均为18种元素 | |
| C. | 乙元素的族序数比甲元素的族序数小 | |
| D. | 甲、丙元素最高价氧化物对应水化物的酸性强弱:甲<丙 |
2.一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质:①石墨粉 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥氯化钠溶液 ⑦硝酸钾溶液 ⑧氯化铜时,能够加快反应速率,又不影响产生H2的总量的是( )
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
19.下列说法错误的是( )
| A. | SiO2是沙子的主要成分,纯净的SiO2是光纤制品的基本原料 | |
| B. | 水晶的基本结构单元是[SiO4]四面体结构 | |
| C. | 将游离态的氮转变为氮的化合物就是氮的固定,合成氨是一种人工固氮方法 | |
| D. | 将等物质的量的氯气和二氧化硫同时通入品红溶液中,褪色比二氧化硫通入品红溶液快 |
6.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑.有关该反应的说法不正确的是( )
| A. | 该反应中的还原剂是C、氧化剂是S和KNO3 | |
| B. | 能做炸药的原因之一是固体物质反应生成了大量的气体 | |
| C. | 由此反应可推出S的氧化性强于N2 | |
| D. | 当生成标准状况下4.48L气体时,共转移电子0.6 mol |
3.某有机物结构简式如图,下列叙述不正确的是( )
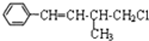
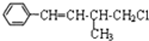
| A. | 1mol该有机物在加热和催化剂作用下,最多能和4molH2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
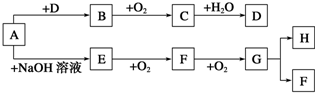
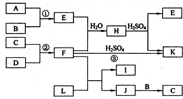 图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.
图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.