题目内容
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206kJ?mol-1CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247kJ?mol-1
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
| A、797.5kJ/mol |
| B、900.5kJ/mol |
| C、962.5kJ/mol |
| D、1595kJ/mol |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:依据盖斯定律,利用热化学方程式计算得到CH4(g)+2H2O(g)═CO2(g)+4H2(g)的反应热,结合反应热=拆化学键吸收的能量-形成化学键放出的能量解题.
解答:
解:设C=O键的键能为x,
①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ?mol-1
依据盖斯定律①×2-②得到:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165 kJ?mol-1,
+165=413×4+463×4-C=2x-436×4
解得:x=797.5kJ/mol
故选A.
①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ?mol-1
依据盖斯定律①×2-②得到:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165 kJ?mol-1,
+165=413×4+463×4-C=2x-436×4
解得:x=797.5kJ/mol
故选A.
点评:本题考查盖斯定律、依据反应热计算化学键键能的方法,题目难度中等,侧重反应原理的考查.

练习册系列答案
相关题目
PCl5(气)?PCl3(气)+Cl2(气)△H>0 当反应达到平衡时,下列措施:①降温 ②恒容通入惰性气体 ③增加Cl2的浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高PCl5质量分数的是( )
| A、①②④ | B、①③④ |
| C、②③⑥ | D、③⑤⑥ |
下列物质,按熔点由低到高的顺序排列的是( )
①SiO2、NaCl、Na、CH4;
②NaCl、Na、H2O、CH4;
③F2、Cl2、Br2、I2;
④H2、Na、NaCl、Si.
①SiO2、NaCl、Na、CH4;
②NaCl、Na、H2O、CH4;
③F2、Cl2、Br2、I2;
④H2、Na、NaCl、Si.
| A、①③ | B、②④ | C、①② | D、③④ |
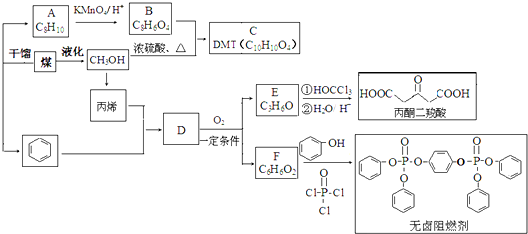
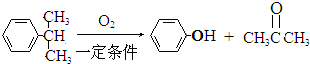
某有机物甲经氧化后得乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2).由此推断甲的结构简式为( )
| A、HO-CH2-CH2-OH |
B、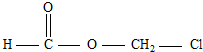 |
C、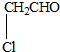 |
D、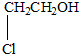 |
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32? |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42? |
| C、加入氯水后再加入KSCN溶液,溶液变红色,一定有Fe2+ |
| D、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
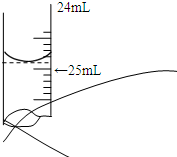 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题: