题目内容
7.某同学将铁片A和碳棒B用导线连接后放入食盐水中模拟菜刀生锈过程,则下列叙述错误的是( )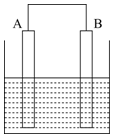
| A. | 导线中有电子流动,电流方向为A流向B | |
| B. | 溶液中的O2在电极B得电子,电极B附近碱性增强 | |
| C. | 电极A上的电极反应式为Fe-2e-=Fe2+ | |
| D. | 溶液中的Na+向电极B附近移动 |
分析 将铁片A和碳棒B用导线连接后放入食盐水中,由于食盐水为中性溶液,故发生铁片的吸氧腐蚀,铁片做负极,碳棒做正极,据此分析.
解答 解:将铁片A和碳棒B用导线连接后放入食盐水中,由于食盐水为中性溶液,故发生铁片的吸氧腐蚀,铁片做负极,碳棒做正极.
A、原电池中电子由负极流向正极,电流由正极流向负极,故电流由B流向A,故A错误;
B、发生的是钢铁的吸氧腐蚀,氧气在正极B上得电子,电极反应为:O2+4e-+2H2O=4OH-,故电极B附近碱性增强,故B正确;
C、电极A做负极,失电子,电极反应为:Fe-2e-=Fe2+,故C正确;
D、电解质溶液中阳离子移向正极,故移向B极,故D正确.
故选A.
点评 本题考查了钢铁的吸氧腐蚀发生的条件和正负极电极反应的书写,应注意离子移动的方向.

练习册系列答案
相关题目
17.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4$?_{放电}^{充电}$2PbSO4+2H2O下列判断不正确的是( )
| A. | 放电时Pb为负极,此时溶液中的SO42-向Pb电极迁移 | |
| B. | 铅蓄电池电解CuCl2溶液,若制得2.24LCl2(标准状况),这时电池内消耗的H2SO4至少0.2mol | |
| C. | 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极上 | |
| D. | 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
15.提纯下列物质(括号内物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | CCl4 | 萃取、分液 |
| B | 苯(苯酚) | 浓溴水 | 过滤 |
| C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| D | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
2.H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g),1molH2完全反应放出akJ热量.
已知:
 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
已知:
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1molH-H键和1molI-I键所需能量大于断开2molH-I键所需能量 | |
| C. | 断开2molH-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2molH2和2molI2,充分反应放出的热量大小2akJ |
12.某同学在实验室做铜与浓硫酸反应的实验.
(1)写出反应的化学方程式2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
停止加热,将试管中的混合物冷却后倒入装有冷水的烧杯中,搅拌、静置,观察到烧杯底部有黑色物质.于是他对黑色物质进行了探究.
(2)该同学假设黑色物质是CuO.检验过程如下:
【查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐红沉淀,证明有Cu2+】该同学的实验操作:
①将CuO放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色物质放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
实验①的目的是做对比实验由该检验过程所得结论是黑色沉淀中不含CuO.
(3)再次假设,黑色物质是铜的硫化物.实验如下:
①现象2说明黑色物质具有还原性.
②A试管上方产生浅红棕色气体的化学方程式是2NO+O2=2NO2.
③能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀.
(4)以上实验说明,黑色物质中存在铜的硫化物.进一步实验后证明黑色物质是CuS与Cu2S的混合物.已知1molCu2S与稀硝酸反应转移8mole-,写出试管A中Cu2S溶解的化学方程式3Cu2S+20HNO3$\frac{\underline{\;\;△\;\;}}{\;}$6Cu(NO3)2+3SO2↑+8NO↑+10H2O.
(1)写出反应的化学方程式2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
停止加热,将试管中的混合物冷却后倒入装有冷水的烧杯中,搅拌、静置,观察到烧杯底部有黑色物质.于是他对黑色物质进行了探究.
(2)该同学假设黑色物质是CuO.检验过程如下:
【查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐红沉淀,证明有Cu2+】该同学的实验操作:
①将CuO放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色物质放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
实验①的目的是做对比实验由该检验过程所得结论是黑色沉淀中不含CuO.
(3)再次假设,黑色物质是铜的硫化物.实验如下:
 | 现象 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现浅红棕色气体 3B试管中出现白色沉淀 |
②A试管上方产生浅红棕色气体的化学方程式是2NO+O2=2NO2.
③能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀.
(4)以上实验说明,黑色物质中存在铜的硫化物.进一步实验后证明黑色物质是CuS与Cu2S的混合物.已知1molCu2S与稀硝酸反应转移8mole-,写出试管A中Cu2S溶解的化学方程式3Cu2S+20HNO3$\frac{\underline{\;\;△\;\;}}{\;}$6Cu(NO3)2+3SO2↑+8NO↑+10H2O.
19.在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A. | v(A)=0.4mol•L-1•s-1 | B. | v(B)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.9 mol•L-1•s-1 | D. | v(D)=1 mol•L-1•s-1 |
16.下列除去括号内杂质的有关操作方法正确的是( )
| 物质(杂质) | 操作方法 | |
| A | 苯(硝基苯) | 加少量蒸馏水,分液 |
| B | 乙醇(水) | 加新制的生石灰,蒸馏 |
| C | CO2(HCl) | NaOH溶液,洗气 |
| D | 乙烷(乙烯) | 酸性KMnO4溶液,洗气 |
| A. | A | B. | B | C. | C | D. | D |
17.下列分子式只能表示一种物质的是( )
| A. | C3H7Cl | B. | C3H6 | C. | CH2Cl2 | D. | C2H6O |