题目内容
16.下列除去括号内杂质的有关操作方法正确的是( )| 物质(杂质) | 操作方法 | |
| A | 苯(硝基苯) | 加少量蒸馏水,分液 |
| B | 乙醇(水) | 加新制的生石灰,蒸馏 |
| C | CO2(HCl) | NaOH溶液,洗气 |
| D | 乙烷(乙烯) | 酸性KMnO4溶液,洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯、硝基苯混溶;
B.水与氧化钙反应生成氢氧化钙,可增大混合物的沸点差;
C.二者都与氢氧化钠溶液反应;
D.乙烯被氧化生成二氧化碳,引入新杂质.
解答 解:A.苯、硝基苯混溶,溶液不分层,应用蒸馏的方法分离,故A错误;
B.水与氧化钙反应生成氢氧化钙,然后蒸馏即可的得到纯净的乙醇,故B正确;
C.二者都与氢氧化钠溶液反应,应用饱和碳酸氢钠溶液除杂,故C错误;
D.乙烯被氧化生成二氧化碳,引入新杂质,应用溴水除杂,乙烯可与溴水发生加成反应而除去,故D错误.
故选B.
点评 本题考查物质的分离、提纯问题,侧重于学生的分析能力和实验能力的考查,题目难度不大,本题注意根据物质的性质选择分离方法,注意不能引入新的杂质.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
7.某同学将铁片A和碳棒B用导线连接后放入食盐水中模拟菜刀生锈过程,则下列叙述错误的是( )
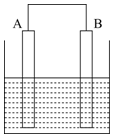

| A. | 导线中有电子流动,电流方向为A流向B | |
| B. | 溶液中的O2在电极B得电子,电极B附近碱性增强 | |
| C. | 电极A上的电极反应式为Fe-2e-=Fe2+ | |
| D. | 溶液中的Na+向电极B附近移动 |
4.乙炔和电石(CaC2)都是重要的化工原料.
(1)电石可由焦炭与氧化钙固体在电炉中高温制得,同时生成一氧化碳气体.
①每生成1.00g固态CaC2吸收7.25kJ的热量,该制备反应的热化学方程式为CaO(s)+3C(s)$\frac{\underline{\;高温\;}}{\;}$CaC2(s)+CO(g)△H=+464kJ/mol
②CaC2与H2O反应的化学方程式为CaC2+2H2O=Ca(OH)2+HC≡CH↑
③炼钢时可用电石将钢水中FeO转变为铁,同时有一氧化碳等物质生成,该反应的化学方程式为3FeO+CaC2$\frac{\underline{\;高温\;}}{\;}$3Fe+CaO+2CO↑
(2)已知下列反应:
CH4 (g)+2O2(g)═CO2(g)+2H2O(g)△H1=akJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g)△H2=bkJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H3=ckJ•mol-1
2CH4(g)═C2H2(g)+3H2(g)△H4
①△H4=$\frac{4a-b-3c}{2}$kJ•mol-1(用含a、b、c的代数式表示).
②已知下列键能数据:
则△H4=+360.4kJ•mol-1(填数值).
(3)在压强为1×105kPa的恒压密闭容器中充入1mol乙炔和1molHCl气体,加入催化剂,乙炔与HCl发生反应:HC≡CH(g)+HCl(g)?CH2=CHCl(g),乙炔的平衡转化率与温度的关系如图所示:

①该反应的△H<0(填“>”或“<”),N点时乙炔的反应速率v(正)>v(逆) (填“>”、“<”或“=”).
②M点对应温度的平衡常数Kp=9.9×10-4(kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并注明单位)
(1)电石可由焦炭与氧化钙固体在电炉中高温制得,同时生成一氧化碳气体.
①每生成1.00g固态CaC2吸收7.25kJ的热量,该制备反应的热化学方程式为CaO(s)+3C(s)$\frac{\underline{\;高温\;}}{\;}$CaC2(s)+CO(g)△H=+464kJ/mol
②CaC2与H2O反应的化学方程式为CaC2+2H2O=Ca(OH)2+HC≡CH↑
③炼钢时可用电石将钢水中FeO转变为铁,同时有一氧化碳等物质生成,该反应的化学方程式为3FeO+CaC2$\frac{\underline{\;高温\;}}{\;}$3Fe+CaO+2CO↑
(2)已知下列反应:
CH4 (g)+2O2(g)═CO2(g)+2H2O(g)△H1=akJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g)△H2=bkJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H3=ckJ•mol-1
2CH4(g)═C2H2(g)+3H2(g)△H4
①△H4=$\frac{4a-b-3c}{2}$kJ•mol-1(用含a、b、c的代数式表示).
②已知下列键能数据:
| 共价键 | C-H | H-H | C≡C |
| 键能/kJ•mol-1 | 413.4 | 436 | 812 |
(3)在压强为1×105kPa的恒压密闭容器中充入1mol乙炔和1molHCl气体,加入催化剂,乙炔与HCl发生反应:HC≡CH(g)+HCl(g)?CH2=CHCl(g),乙炔的平衡转化率与温度的关系如图所示:

①该反应的△H<0(填“>”或“<”),N点时乙炔的反应速率v(正)>v(逆) (填“>”、“<”或“=”).
②M点对应温度的平衡常数Kp=9.9×10-4(kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并注明单位)
1.现有两个热化学方程式:下列说法中正确的是( )
| A. | 反应①②中都存在:△S>0  (1)+H2(g)→ (1)+H2(g)→ (1)△H>0① (1)△H>0① | |
| B. | 反应②高温时,可自发进行 | |
| C. | 在通常情况下,①②都能自发进行 (1)+H2(g)→ (1)+H2(g)→ (1)△H<0② (1)△H<0② | |
| D. | 反应①一定不能自发进行 |
8.下列科学家与其科学成果对应关系正确的是( )
| A. | 道尔顿:分子学说 | B. | 汤姆生:射线的发现 | ||
| C. | 卢瑟福:原子结构的行星模型 | D. | 伦琴:原子的葡萄干面包模型 |
5.结合图判断,下列叙述正确的是( )


| A. | Ⅰ和Ⅱ中正级均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正级反应均是O2+2H2O+4e-=4OH- | |
| D. | Ⅰ和Ⅱ中均有Fe2+生成 |

 ;
;
 +(2n-1)H2O.
+(2n-1)H2O.