题目内容
在指定环境中,下列各组离子可以大量共存的是( )
| A、在澄清透明的无色溶液中:Cl-、MnO4-、Al3+、SO42-、Ca2+ |
| B、在强酸性溶液中:Na+、SO42-、NO3-、HCO3-、NH4+ |
| C、在强碱性溶液中:SO32-、K+、Na+、CO32-、CH3COO- |
| D、使石蕊试纸变蓝的溶液中:Cu2+、NO3-、Na+、SO42-、Ag+ |
考点:离子共存问题
专题:
分析:A.无色溶液说明不含有颜色的离子,离子之间不反应;
B.强酸性条件下,不能大量存在和氢离子反应的离子;
C.强碱性条件下,不能大量存在和氢氧根离子反应的离子,且离子之间不反应;
D.使石蕊试纸变蓝的溶液呈碱性,离子之间不反应且和氢氧根离子不反应.
B.强酸性条件下,不能大量存在和氢离子反应的离子;
C.强碱性条件下,不能大量存在和氢氧根离子反应的离子,且离子之间不反应;
D.使石蕊试纸变蓝的溶液呈碱性,离子之间不反应且和氢氧根离子不反应.
解答:
解:A.无色溶液说明不含有颜色的离子,离子之间不反应,MnO4-呈紫色,且能氧化氯离子,故A错误;
B.强酸性条件下,不能大量存在和氢离子反应的离子,HCO3-和氢离子反应生成二氧化碳和水,故B错误;
C.这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故C正确;
D.使石蕊试纸变蓝的溶液呈碱性,SO42-、Ag+反应生成沉淀且氢氧根离子和银离子反应,故D错误;
故选C.
B.强酸性条件下,不能大量存在和氢离子反应的离子,HCO3-和氢离子反应生成二氧化碳和水,故B错误;
C.这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故C正确;
D.使石蕊试纸变蓝的溶液呈碱性,SO42-、Ag+反应生成沉淀且氢氧根离子和银离子反应,故D错误;
故选C.
点评:本题考查离子共存,为高考高频点,涉及复分解反应、氧化还原反应,明确复分解反应条件及氧化还原反应内涵即可解答,题目难度不大.

练习册系列答案
相关题目
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
| A、2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);△H=-57.3 kJ/mol | ||||
B、KOH(aq)+
| ||||
C、C8H18(l)+
| ||||
| D、2C8H18(g)+25O2(g)=16CO2(g)+18 H2O(1);△H=-5518 kJ/mol |
现有各1mol的HCl、H2O、NH3三种物质,则三种物质所含有的H原子的物质的量之比为( )
| A、1:1:1 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:2:3 |
下列仪器可以用酒精灯直接加热的是( )
| A、试管 | B、烧杯 | C、烧瓶 | D、锥形瓶 |
在BaCl2溶液中通入SO2气体,溶液仍澄清.将BaCl2溶液分别盛入两支试管中,一支加氨水,另一支加硝酸溶液,然后再通入SO2,结果两试管都有白色沉淀.由此得出的下列结论中合理的是( )
| A、BaCl2有两性 |
| B、两支试管的白色沉淀均是亚硫酸钡 |
| C、SO2有还原性和酸性氧化物的通性 |
| D、以上说法均不合理 |
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(s)+bB(g)?cC(g)表示]的化学平衡的影响,得到如图图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,?表示体积分数).根据图象,下列判断正确的是( )
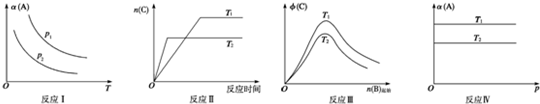

| A、反应Ⅰ:若p1<p2,则a+b<c |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应Ⅲ:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
已知一定条件下断裂或生成某些化学键的能量关系如下表:对于反应:H2(g)+Cl2 (g)=2HCl (g),下列说法正确的是( )
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量 436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量 243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量 431kJ |
| A、该反应的反应热△H>0 |
| B、生成1mol HCl时反应放热91.5kJ |
| C、Cl2中的化学键比H2中的化学键更稳定 |
| D、相同条件下,氢气分子具有的能量高于氯气分子具有的能量 |
下列各组物质的燃烧热相等的是( )
| A、碳和一氧化碳 |
| B、1 mol碳和3 mol碳 |
| C、3 mol C2H2和1 mol C6H6 |
| D、金刚石和石墨 |