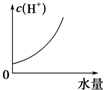
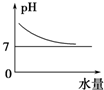
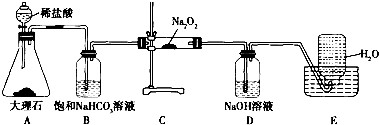
题目内容
8.相同物质的量的H2O和H2O2,所含的分子数目之比为1:1;所含氧原子的数目之比为1:2,氧原子的物质的量之比为1:2;所含H原子数目之比为1:1,H原子物质的量之比为1:1,所含原子的物质的量之比为3:4.分析 根据N=nNA可知,物质的量相等时,含有分子数与物质的量成正比,结合H2O和H2O2的分子组成分别计算出含有氧原子、氢原子的数目、物质的量之比即可.
解答 解:物质的量与含有分子数成正比,则相同物质的量的H2O和H2O2,所含的分子数目之比为1:1;所含氧原子的数目之比为1:(1×2)=1:2,氧原子的物质的量之比也是1:2;所含H原子数目之比为(1×2):(1×2)=1:1,H原子物质的量之比也是1:1;所含原子的物质的量之比为(1×3):(1×4)=3:4,
故答案为:1:1;1:2;1:2;1:1;1:1;3:4.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列反应中,属于消去反应的是( )
| A. | 溴乙烷和氢氧化钠溶液混合共热 | |
| B. | 一氯甲烷和苛性钠的乙醇溶液混合共热 | |
| C. | 氯苯与氢氧化钠溶液混合共热 | |
| D. | 1-溴丁烷与氢氧化钾的乙醇溶液混合共热 |
16.取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量小于ag的是( )
| A. | C2H4O4 | B. | CO | C. | C6H12O6 | D. | C12H22O11 |
3.某溶液中有Ca2+、NH${\;}_{4}^{+}$、Mg2+、Fe2+和Al3+五种离子,若向其中加入过量的氢氧化钠溶液微热并搅拌,再加入过量盐酸,溶液中的阳离子基本不减少的是( )
| A. | NH${\;}_{4}^{+}$ | B. | Mg2+ | C. | Fe2+ | D. | Al3+ |
10.关于${\;}_{16}^{34}$S的叙述正确的是( )
| A. | 核电荷数为34 | B. | 中子数为16 | C. | 核外电子数为18 | D. | 原子序数为16 |
7.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| C. | 用氨水溶液氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H20 | |
| D. | Fe(OH)3 溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
8.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |