题目内容
发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
下列关于肼和NO2反应的热化学方程式中,正确的是( )
| A、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7kJ/mol | ||
| B、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3kJ/mol | ||
C、N2H4(g)+NO2(g)=
| ||
| D、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ/mol |
考点:热化学方程式
专题:化学反应中的能量变化
分析:该题是利用盖斯定律的计算,首先书写出化学方程式,在利用两个已知方程式推导出目标方程式,从而求出正确的热化学方程式.
解答:
解:N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ/mol ①
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ/mol ②
写出目标方程式为2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)
可以通过①②联立,2×②-①得到即2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g),△H=2×②-①=2×(-534kJ/mol)-(+67.7kJ/mol)=-1135.7kJ/mol.
故选:D.
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ/mol ②
写出目标方程式为2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)
可以通过①②联立,2×②-①得到即2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g),△H=2×②-①=2×(-534kJ/mol)-(+67.7kJ/mol)=-1135.7kJ/mol.
故选:D.
点评:盖斯定律的应用关键在于写出正确的化学方程式以及状态.再一个注意方程式之间的关系,

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
M、N、P、E四种金属,①M+N ═N+M2+ ②M、P用导线连接放入硫酸氢钠溶液中,M表示有大量气泡 ③N、E用导线连接放入E的硫酸溶液中,电极反应为E2++2e-═E,N-2e-═N2+.四种金属的还原性由强到弱顺序是( )
| A、PMNE | B、ENMP |
| C、PNME | D、EPMN |
下列分散系属于胶体的是( )
| A、净水剂在水中形成的分散系 |
| B、食盐水 |
| C、石灰乳 |
| D、碘酒 |
①氧化钠、②氢氧化钠、③过氧化钠、④亚硫酸钠1mol上述固体物质放置于空气中,最后质量增加情况是(不考虑潮解因素)( )
| A、①=②>③>④ |
| B、①>③>④>② |
| C、②>①=③>④ |
| D、④>②>③>① |
将SO2 通入 BaCl2 溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是( )
| A、CO2 |
| B、NH3 |
| C、H2S |
| D、Cl2 |
下列反应的离子方程式正确的是( )
| A、铜和稀硝酸的反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| B、盐酸加到氢氧化铁中:H++OH-═H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+═H2O+CO2↑ |
| D、Ba(OH)2和(NH4)2SO4溶液混合加热:Ba2++SO42-═BaSO4↓ |
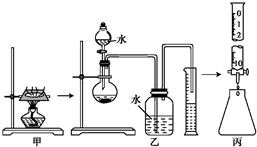 某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题:
某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题: