题目内容
1.有关物质的转化关系如图所示(部分物质与条件已略去).X、Y、Z是三种常见金属单质,Z为紫红色,A是一种常见的酸,B的焰色反应呈紫色(透过蓝色钴玻璃),D为红褐色固体,F可用作净水剂.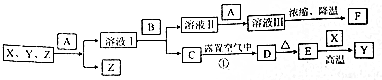
请回答下列问题:
(1)F、Z的化学式分别为KAl(SO4)2.12H2O、Cu.
(2)检验F中阴离子的操作方法是取少量F于试管中配成溶液,再向其中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则证明含有SO42-.
(3)写出溶液Ⅰ转化为溶液Ⅱ的离子方程式Al3++4OH-=AlO2-+2H2O.
(4)写出反应①的化学方程式4Fe(OH)2+2H2O+O2=4Fe(OH)3,该反应中每消耗2.24L(标准状况)O2,转移的电子的物质的量为0.4mol.
分析 X、Y、Z是三种常见金属单质,Z为紫红色,则Z为Cu;B的焰色反应呈紫色(透过蓝色钴玻璃),B中含有K元素,C在空气中放置生成D为红褐色固体,则C为Fe(OH)2、D为Fe(OH)3,D加热生成E为Fe2O3,金属X与氧化铁反应得到Fe,为铝热反应,则X为Al,Y为Fe,溶液1中含有铝盐、亚铁盐,与B反应生成氢氧化铁与溶液Ⅱ,则B为KOH,溶液Ⅱ中含有KAlO2,溶液Ⅱ中加入常见的酸A得到溶液Ⅲ,再经过浓缩、降温得到F,F可用作净水剂,可知A为硫酸、F为KAl(SO4)2.12H2O.
解答 解:X、Y、Z是三种常见金属单质,Z为紫红色,则Z为Cu;B的焰色反应呈紫色(透过蓝色钴玻璃),B中含有K元素,C在空气中放置生成D为红褐色固体,则C为Fe(OH)2、D为Fe(OH)3,D加热生成E为Fe2O3,金属X与氧化铁反应得到Fe,为铝热反应,则X为Al,Y为Fe,溶液1中含有铝盐、亚铁盐,与B反应生成氢氧化铁与溶液Ⅱ,则B为KOH,溶液Ⅱ中含有KAlO2,溶液Ⅱ中加入常见的酸A得到溶液Ⅲ,再经过浓缩、降温得到F,F可用作净水剂,可知A为硫酸、F为KAl(SO4)2.12H2O.
(1)F、Z的化学式分别为KAl(SO4)2.12H2O、Cu,故答案为:KAl(SO4)2.12H2O;Cu;
(2)F中阴离子为硫酸根离子,检验硫酸根离子方法是:取少量F于试管中配成溶液,再向其中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则证明含有SO42-,
故答案为:取少量F于试管中配成溶液,再向其中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则证明含有SO42-;
(3)溶液Ⅰ转化为溶液Ⅱ的离子方程式:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(4)反应①的化学方程式:4Fe(OH)2+2H2O+O2=4Fe(OH)3,该反应中每消耗2.24L(标准状况)O2,其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,转移的电子的物质的量为0.1mol×4=0.4mol,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;0.4.
点评 本题考查无机物推断,涉及Al、Fe等元素单质化合物性质,物质的颜色、反应现象及转化中特殊反应等是推断突破口,需要学生熟练掌握元素化合物性质,涉及电子式,是对学生综合能力的考查,难度中等.

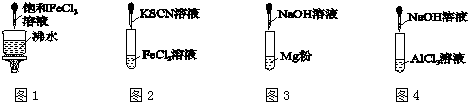
| A. | 图1产生红褐色沉淀 | |
| B. | 图2溶液颜色变红 | |
| C. | 图3放出大量气体 | |
| D. | 图4先出现白色胶状沉淀,后沉淀溶解 |
| A. | 液氨气化 | B. | 酸城中和 | C. | 浓硫酸加水稀释 | D. | 镁条与盐酸反应 |
| A. | 铁螺丝连接锌板时,铁不容易生锈 | |
| B. | 反应CaC03(s)=Ca0(s)+C02(g)在常温下不能发生,则该反应的△H<0 | |
| C. | pH=11的NaOH溶液与pH=3的CH3COOH溶液混合后所得溶液pH小于7 | |
| D. | 电解精炼铜时,每转移1mol电子阳极上溶解的铜原子数小于0.5×6.02×1023 |

Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
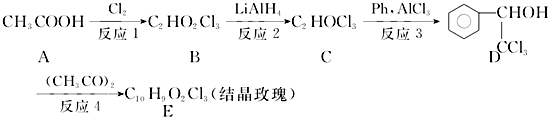
 如图表示某有机反应,该反应的类型是( )
如图表示某有机反应,该反应的类型是( )| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 聚合反应 |
| A. | 升华 | B. | 蒸馏 | C. | 萃取 | D. | 过滤 |
 .
.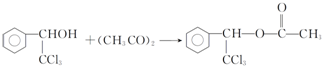 .
.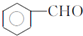 ,F与氯仿合成D的反应方程式为
,F与氯仿合成D的反应方程式为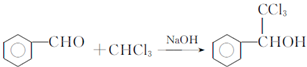 .已知2分子F在KCN存在下可通过授受H反应生成安息香
.已知2分子F在KCN存在下可通过授受H反应生成安息香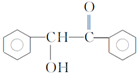 ,请写出上述反应方程式
,请写出上述反应方程式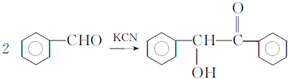 .
. .
.