题目内容
12.对下列各实验现象的判断正确的是( )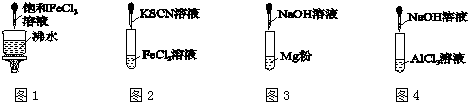
| A. | 图1产生红褐色沉淀 | |
| B. | 图2溶液颜色变红 | |
| C. | 图3放出大量气体 | |
| D. | 图4先出现白色胶状沉淀,后沉淀溶解 |
分析 A.将氯化铁饱和溶液加入到沸水中可得到氢氧化铁胶体;
B.三价铁离子遇硫氰化钾变红色;
C.镁与碱不反应;
D.氯化铝与氢氧化钠反应先生成白色沉淀后沉淀溶解.
解答 解:A.将氯化铁饱和溶液加入到沸水中加热至溶液呈红褐色可得到氢氧化铁胶体,故A错误;
B.三价铁离子遇硫氰化钾变红色,二价铁离子不变色,故B错误;
C.镁与氢氧化钠溶液不反应,故C错误;
D.氯化铝与氢氧化钠反应先生成氢氧化铝白色沉淀,氢氧化铝可与氢氧化钠继续反应生成可溶性的偏氯酸钠,故D正确.
故选D.
点评 本题考查元素及其化合物的性质,明确物质间的反应是解题的关键,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
7.两种气态烃组成的混合气体0.1mol,完全燃烧得0.2mol CO2和2.7g H2O,下列说法正确的是( )
| A. | 混合气体中一定有甲烷 | B. | 混合气体可能是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烷 | D. | 混合气体可能是乙烯和乙炔 |
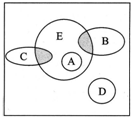 如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.
如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型. ;
; ;
;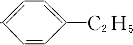 、
、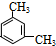 .
. 实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.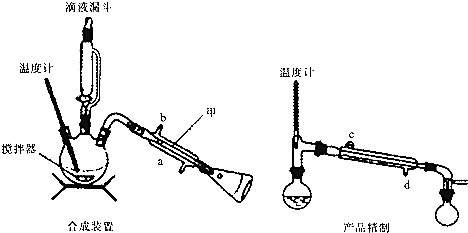
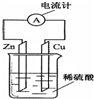 如图是铜锌原电池的装置示意图.回答下列问题:
如图是铜锌原电池的装置示意图.回答下列问题: