题目内容
5.下列说法正确的是( )| A. | 沸点由低到高的顺序为:CH3CH2CH3<CH3(CH2)2CH3<(CH3)3CH | |
| B. | 工业上合成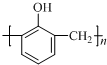 的单体为甲醛和苯酚( 的单体为甲醛和苯酚(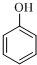 ) ) | |
| C. | 相同质量的乙烯和乙酸完全燃烧时,消耗氧气的量相同 | |
| D. | 某烷烃可以命名为2,3,3-三甲基-4-乙基戊烷 |
分析 A.饱和烃中碳原子个数越多其熔沸点越高,碳原子个数相等的饱和烃,支链越少其熔沸点越高;
B. 为酚醛树脂;
为酚醛树脂;
C.乙醇的分子式为C2H6O,可看成C2H6.H2O,而乙酸的分子式为C2H4O2,可看成C2.2H2O;
D.主链错误,应为6个C原子.
解答 解:A.饱和烃中碳原子个数越多其熔沸点越高,碳原子个数相等的饱和烃,支链越少其熔沸点越高,应为CH3CH2CH3<(CH3)3CH<CH3(CH2)2CH3,故A错误;
B. 为酚醛树脂,单体为甲醛和苯酚(
为酚醛树脂,单体为甲醛和苯酚( ),发生缩聚反应生成,故B正确;
),发生缩聚反应生成,故B正确;
C.乙醇的分子式为C2H6O,可看成C2H6.H2O,而乙酸的分子式为C2H4O2,可看成C2.2H2O,则等物质的量的乙醇和乙酸完全燃烧时,乙醇所需氧气的质量大,故C错误;
D.主链错误,应为6个C原子,正确命名为2,3,3,4-四甲基己烷,故D错误.
故选B.
点评 本题考查较综合,涉及有机物燃烧反应、命名、高分子化合物等,综合性较强,注重基础知识的考查,选项C注意利用分子式变形简化分析,题目难度不大.

练习册系列答案
相关题目
15.同温同压下,KMnO4、KClO3、H2O2分解产生相同体积的氧气,三个反应中转移的电子数之比为( )
| A. | 1:1:l | B. | 1:1:2 | C. | 2:2:1 | D. | 4:3:2 |
16.实验室进行下列实验时,一定不需要使用“沸石”的是( )
| A. | 制乙酸丁酯 | B. | 分馏石油 | C. | 制取乙烯 | D. | 溴乙烷的水解 |
17.下列实验“操作”“现象”与“结论”都正确的是( )
| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
14.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 12 g C60中含有的碳原子数为60NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
1. 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
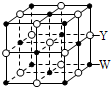 X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题:
X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题: