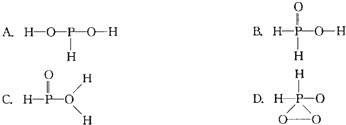题目内容
13.下列氧化还原反应的方程式配平正确的是( )| A. | Fe3++S2-=Fe2++S | B. | Fe3++Fe=2Fe2+ | ||
| C. | Fe2++Cl2=Fe3++2Cl- | D. | 2Fe3++2I-=2Fe2++I2 |
分析 A、铁离子得到1个电子,而硫离子失去2个电子,所以得失电子不守恒;
B、铁失去2个电子,而1个铁离子只能得到1个电子,所以得失电子不守恒;
C、亚铁离子失去1个电子,而氯气得到2个电子,所以得失电子不守恒;
D、2个铁离子得到2个电子,而2个碘离子失去2个电子.
解答 解:A、铁离子得到1个电子,而硫离子失去2个电子,所以得失电子不守恒,所以正确的离子方程式为:2Fe3++S2-=2Fe2++S,故A错误;
B、铁失去2个电子,而1个铁离子只能得到1个电子,所以得失电子不守恒,所以正确的离子方程式为:2Fe3++Fe=3Fe2+,故B错误;
C、亚铁离子失去1个电子,而氯气得到2个电子,所以正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故C错误
D、2个铁离子得到2个电子,而2个碘离子失去2个电子,得失电子守恒,电荷守恒,故D正确;
故选D.
点评 本题考查氧化还原反应的配平,根据转移的电子数守恒进行的配平,明确元素的化合价变化是解答本题的关键,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
7. 已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
 已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )| A. | ZX2为酸性氧化物,只能与碱溶液反应 | |
| B. | 简单氢化物的热稳定性:Z<W | |
| C. | 化合物YWX中既含离子键,又含共价键 | |
| D. | W的最高价氧化物对应的水化物为强酸 |
8.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴丙烷水解制丙醇;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由丙烯与水反应制丙醇 |
18.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),下列说法正确的是( )
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 使用高效催化剂只能提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率为零 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
5.下列说法正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| C. | 浓氨水中滴加饱和FeCl3溶液可制得氢氧化铁胶体 | |
| D. | 胶体不一定是液态,胶体的丁达尔效应属于物理变化 |
2.下列离子方程式正确的是( )
| A. | 过量铁粉溶于稀HNO3中:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| B. | 过量NaHSO4溶液加入到Ba(OH)2溶液中:2H++SO42-+Ba2++2 OH-═2H2O+BaSO4↓ | |
| C. | 少量Cl2通人FeBr2溶液中:2 Br-+Cl2═2 Cl-+Br2 | |
| D. | 少量 AlCl3溶液滴入到氨水中:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
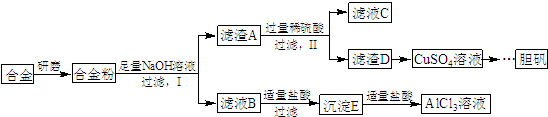
 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
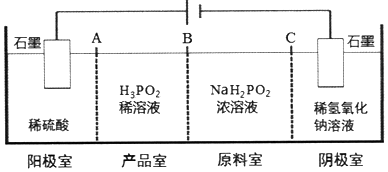
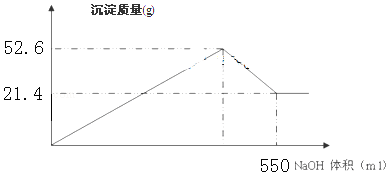
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.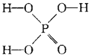 )子中的三个氢原子都可以与重水分子(对D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)
)子中的三个氢原子都可以与重水分子(对D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)