题目内容
5.(1)已知酸HA、HB、HC三溶液的物质的量浓度和体积均相同,测得它们的PH值分别为2、2.7、3,分别与足量的锌反应,初始时,三者的反应速率HA>HB>HC,产生的氢气的物质的量相等.(2)若三种酸的体积与PH值均相等时,分别加入足量的表面积和质量均相等的锌,初始时,三者的反应速率HA>HB>HC,充分反应后,产生的氢气的物质的量的相等.
分析 酸HA、HB、HC三溶液的物质的量浓度和体积均相同,测得它们的PH值分别为2、2.7、3,pH越大,溶液中c(H+)越小,则酸越弱,以此解答该题.
解答 解:酸HA、HB、HC三溶液的物质的量浓度和体积均相同,测得它们的PH值分别为2、2.7、3,pH越大,溶液中c(H+)越小,则酸越弱,则酸性,HA>HB>HC,因酸的物质的量相等,则生成氢气的体积相等,
故答案为:HA>HB>HC;相等.
点评 本题考查弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点,难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
15.将标准状况下33.6L HCl溶于水配成250mL溶液,现用此盐酸与19.5g锌粒反应制取氢气.试计算:(写出计算过程)
(1)此盐酸的物质的量浓度;
(2)若要使锌完全反应,则所需盐酸的最小体积.
(1)此盐酸的物质的量浓度;
(2)若要使锌完全反应,则所需盐酸的最小体积.
13.R2O8n-离子在一定条件下能把Mn2+氧化为MnO4-,若R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,有关叙述正确的是( )
| A. | n值为2 | |
| B. | 氧化产物与还原产物的物质的量比为2:5 | |
| C. | n值为3 | |
| D. | 氧化性R2O8n->MnO4- |
20.在由水电离出的c(H+)=1×10-13mol•L-1的溶液中,可能大量共存的离子组是( )
| A. | Fe2+、NO3-、Na+、Cl- | B. | Mg2+、Na+、CH3COO-、Cl- | ||
| C. | SO42-、HCO3-、K+、Na+ | D. | Ba2+、Na+、NO3-、Cl- |
10.下列说法不正确的是( )
| A. | 在钠、钾、铷三种单质中,钠的熔点最高 | |
| B. | 所有碱金属均为银白色 | |
| C. | 同一主族卤素单质从上到下熔沸点依次升高 | |
| D. | 液溴易挥发,可以通过水封的方式进行保存 |
17.下列说法中错误的是( )
| A. | 0.3 mol H2SO4 | B. | 1 mol H2O | C. | 0.5 mol 硫 | D. | 3 mol 氢原子 |

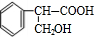 ;E中所含官能团的名称为醛基、羧基.
;E中所含官能团的名称为醛基、羧基.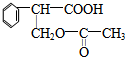 +H2O.
+H2O. .
. .(写出一种即可)
.(写出一种即可)
 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.