题目内容
19.《常用危险化学用品贮存通则》规定:“遇火、遇热、遇潮能引起燃烧、爆炸或发生化学反应,产生有毒气体的化学危险品不得在露天或在潮湿、积水的建筑物中贮存”.下列解释事实的方程式中,不合理的是( )| A. | 贮存液氮的钢瓶防止阳光直射:N2+O2$\frac{\underline{\;阳光\;}}{\;}$2NO | |
| B. | 硝酸铵遇热爆炸:2NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+O2↑+4H2O↑ | |
| C. | 干燥的 AlCl3遇水产生气体:AlCl3+3H2O═Al(OH)3+3HCl↑ | |
| D. | 火灾现场存有电石,禁用水灭火:CaC2→Ca(OH)2+C2H2↑ |
分析 A.液氮中无氧气;
B.硝酸铵在加热时易分解;
C.干燥的氯化铝遇水发生水解;
D.电石的主要成分碳化钙与水反应生成氢气同时放出大量热.
解答 解:A.液氮中无氧气,不发生反应,故A错误;
B.硝酸铵在加热时生成氮气、氧气和水蒸气,故B正确;
C.干燥的氯化铝遇水发生水解,生成氢氧化铝、氯化氢气体,故C正确;
D.电石的主要成分碳化钙与水反应生成氢气,CaC2+2H2O→Ca(OH)2+C2H2↑,故D错误.
故选AD.
点评 本题考查了化学试剂的存放,题目难度不大,需要掌握常见试剂的保存方法,关键是掌握试剂的性质,关键化学性质选择保存方法,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
相关题目
13.R2O8n-离子在一定条件下能把Mn2+氧化为MnO4-,若R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,有关叙述正确的是( )
| A. | n值为2 | |
| B. | 氧化产物与还原产物的物质的量比为2:5 | |
| C. | n值为3 | |
| D. | 氧化性R2O8n->MnO4- |
14.恒温恒压下,在一个可变容积的容器中发生如下反应:
H2(g)+Br2(g)?2HBr(g)已知加入1molH2和2molBr2时,达到平衡后,生成a molHBr,(见下表“已知项”).在相同的条件下,改变起始加入情况,填写表中空白:
H2(g)+Br2(g)?2HBr(g)已知加入1molH2和2molBr2时,达到平衡后,生成a molHBr,(见下表“已知项”).在相同的条件下,改变起始加入情况,填写表中空白:
| 编号 | 起始状态 | 平衡时HBr物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| (1) | 2 | 4 | 0 | 2a |
| (2) | 0 | 0.5 | 1 | 0.5a |
4.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
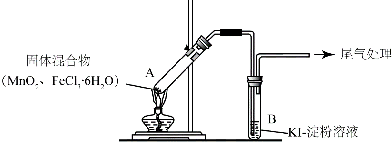
实验操作和现象:
(1)现象i 中的白雾是HCl小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
方案1B中溶液变为蓝色
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | iA中部分固体溶解,上方出现白雾 ii稍后,产生黄色气体,管壁附着黄色液滴 iiiB中溶液变蓝 |
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙色;未检出Fe2+ |
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
8.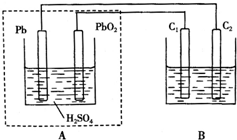 用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
 用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )| A. | 铅蓄电池工作一段时间后A溶液的pH变小 | |
| B. | 当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol | |
| C. | 当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过 | |
| D. | 铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4═PbSO4+2H2O+SO${\;}_{4}^{2-}$ |
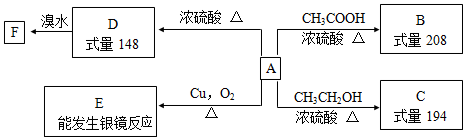
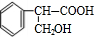 ;E中所含官能团的名称为醛基、羧基.
;E中所含官能团的名称为醛基、羧基.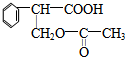 +H2O.
+H2O.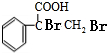 .
.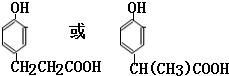 .(写出一种即可)
.(写出一种即可)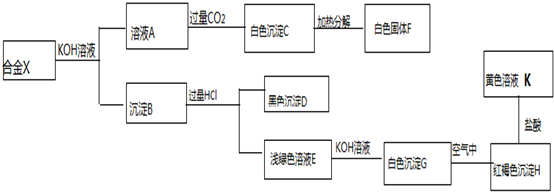

 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.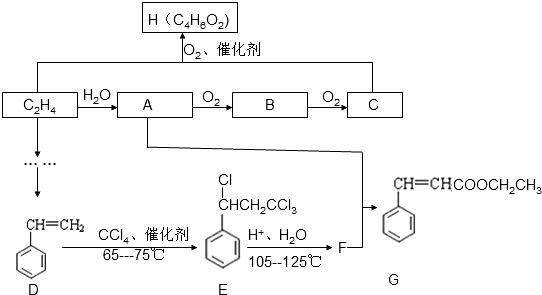
 是G的一种同分异构体
是G的一种同分异构体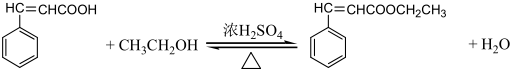 .
.