题目内容
4.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1L1mol/L的氯化铁溶液中,若C1-的数目为3 NA,则Fe3+的数目为NA | |
| B. | 1 molN2和3 molH2在一定条件下充分反应,转移电子数目为6NA | |
| C. | 常温下,1L0.1mol/L的Na2S溶液中阴离子数目大于0.1 NA | |
| D. | 0.1 mol Cl2通入水中,转移电子的数目为0.1NA |
分析 A、铁离子是弱碱阳离子,在溶液中会水解;
B、合成氨的反应为可逆反应;
C、硫离子的水解会导致阴离子个数增多;
D、氯气和水的反应为可逆反应.
解答 解:A、铁离子是弱碱阳离子,在溶液中会水解,故当溶液中C1-的数目为3NA时,Fe3+的个数小于NA,故A错误;
B、合成氨的反应为可逆反应,不能进行彻底,故转移的电子数小于6NA个,故B错误;
C、硫离子的水解会导致阴离子个数增多,故溶液中的阴离子的个数大于0.1NA个,故C正确;
D、氯气和水的反应为可逆反应,故不能进行彻底,故转移的电子数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
10.下列说法正确的是(设NA为阿伏伽德罗常数)
| A. | 标准状况下,2.24LSO3中硫原子数与1L0.1mol•L-1Na2SO3溶液中硫原子数相同 | |
| B. | 1mol•L-1FeCl3溶液全部制成胶体,其中含胶粒的数目小于NA | |
| C. | 1molNa2O2中含有NA个阴离子 | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
15.某可逆反应正向反应过程中能量变化如图所示,下列说法不正确的是( )
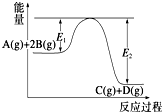

| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 升高温度,平衡常数K减小;压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
12.为了加快漂白粉的作用,最好的方法是( )
| A. | 加入苛性钠溶液 | B. | 用水湿润 | C. | 加少量盐酸 | D. | 加干燥剂使用 |
19.对于反应2SO2+O2$?_{加热}^{催化剂}$2SO3,下列判断正确的是( )
| A. | 达到反应限度时SO2的消耗速率必定等于SO3的生成速率相等 | |
| B. | 平衡时SO2、O2、SO3的分子数之比为2:1:2 | |
| C. | 平衡时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
13.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知:
N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1059.3 kJ/mol | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g);△H=-1076.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1076.7 kJ/mol |
14.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H5OH+3O2═2CO2+3H2O△H=-29.7 kJ/mol | |
| B. | C2H5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=-1366.2kJ/mol | |
| C. | C2 H5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol | |
| D. | C2H5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol |