题目内容
14.SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放.(1)SCR(选择性催化还原)工作原理:
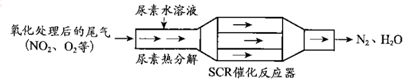
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:CO(NH2)2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CO2↑.
②反应器中NH3还原NO2的化学方程式:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O.
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒.用化学方程式表示(NH4)2SO4的形成:2SO2+O2+4NH3+2H2O═2(NH4)2SO4.
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g•mol-1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol•L-1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol•L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是$\frac{6{c}_{1}{V}_{1}-3{c}_{2}{V}_{2}}{a}%$.
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.
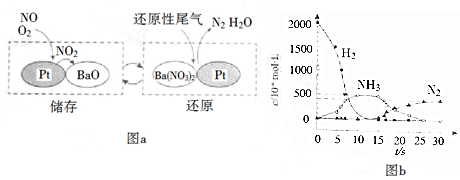
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原.储存NOx的物质是BaO.
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系.第一步反应消耗的H2与Ba(NO3)2的物质的量之比是8:1.
③还原过程中,有时会产生笑气(N2O).用同位素示踪法研究发现笑气的产生与NO有关.在有氧条件下,15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO.将该反应的化学方程式补充完整:415NO+4NH3+3O2$\frac{\underline{\;催化剂\;}}{\;}$415NNO+6H2O.
分析 (1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,结合原子守恒配平书写化学方程式;
②反应器中NH3还原NO2生成氮气和水,根据电子守恒和原子守恒可得此反应的化学方程式;
③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反应的化学方程式;
④涉及反应为2NH3+H2SO4=n(NH4)2SO4,2NaOH+H2SO4=Na2SO4+H2O,由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),以此计算;
(2)①由图a可知储存NOx的物质是BaO;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到-3价,生成氨气,结合得失电子数目相等计算;
③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知15NO与NH3应为1:1,结合电子得失相等配平.
解答 解:(1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,反应物为尿素和水,反应生成物为氨气和水,原子守恒书写化学方程式为:CO(NH2)2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CO2↑,
故答案为:CO(NH2)2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CO2↑;
②NH3在催化剂作用下还原NO2生成氮气和水,反应的化学方程式为8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O,
故答案为:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O;
③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2是还原剂,氧气是氧化剂,反应的化学方程式为2SO2+O2+4NH3+2H2O═2(NH4)2SO4,
故答案为:2SO2+O2+4NH3+2H2O═2(NH4)2SO4;
④涉及反应为2NH3+H2SO4=n(NH4)2SO4,2NaOH+H2SO4=Na2SO4+H2O,反应中n(H2SO4)=v1×c1×10-3mol,n(NaOH)=v2×c2×10-3mol,
由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),
则n(NH3)=(2v1×c1×10-3-v2×c2×10-3)mol,
则m(CO(NH2)2)=$\frac{1}{2}$×(2v1×c1×10-3-v2×c2×10-3)mol×60g/mol=(0.06v1c1-0.03v2c2 )g,
尿素溶液中溶质的质量分数是$\frac{0.06{c}_{1}{V}_{1}-0.03{c}_{2}{V}_{2}}{a}×100%$=$\frac{6{c}_{1}{V}_{1}-3{c}_{2}{V}_{2}}{a}%$,
故答案为:$\frac{6{c}_{1}{V}_{1}-3{c}_{2}{V}_{2}}{a}%$;
(2)①由图示可知BaO和NOx反应生成Ba(NO3)2,Ba(NO3)2再还原为N2,则储存NOx的物质为BaO,故答案为:BaO;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到-3价,生成氨气,则1molBa(NO3)2生成氨气转移16mol电子,参加反应的氢气的物质的量为$\frac{16}{2}$=8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1,
故答案为:8:1;
③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知15NO与NH3应为1:1,可知反应的化学方程式为415NO+4NH3+3O2$\frac{\underline{\;催化剂\;}}{\;}$415NNO+6H2O,
故答案为:415NO+4NH3+3O2;4;6.
点评 本题为2017北京考题,题目以氮氧化物为载体考查元素化合物知识以及化学方程式的相关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握题给信息,结合质量守恒计算该题.

| A. | pH=1的溶液:Na+、K+、MnO4-、SO42- | |
| B. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| C. | 使酚酞变红色的溶液:Na+、Al3+、CO32-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液:K+、Na+、AlO2-、CO32- |
| A. | PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 | |
| B. | 绿色化学要求从源头上消除或减少生产活动对环境的污染 | |
| C. | 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 | |
| D. | 天然气和液化石油气是我国目前推广使用的清洁燃料 |
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为Ca(OH)2、Na2CO3.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:
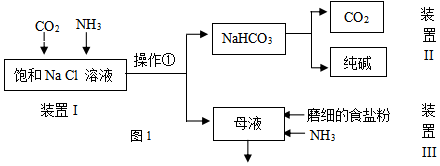
已知:几种盐的溶解度
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
②从平衡移动角度解释该反应发生的原因在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生.
③操作①的名称是过滤.
(3)写出装置II中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)该流程中可循环利用的物质是氯化钠和二氧化碳
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是c.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
| A. | 夏天设定空调温度尽可能的低 | B. | 推广使用一次性塑料袋和纸巾 | ||
| C. | 少开私家车多乘公共交通工具 | D. | 对商品进行豪华包装促进销售 |
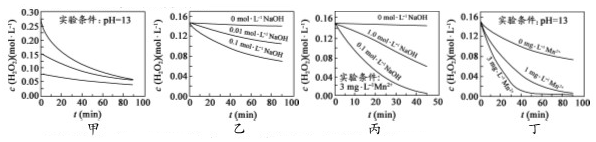
| A. | 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 | |
| B. | 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 | |
| C. | 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 | |
| D. | 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 |

| A. | 装置①可用于实验室制取少量 NH3或 O2 | |
| B. | 可用从 a 处加水的方法检验装置②的气密性 | |
| C. | 实验室可用装置③收集 H2、NH3 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜 |
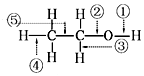
| A. | 当乙醇发生催化氧化时,被破坏的键是②③ | |
| B. | 当乙醇与Na反应时,被破坏的键是① | |
| C. | 当乙醇与乙酸反应时,被破坏的键是② | |
| D. | 当乙醇发生催化氧化时,被破坏的键是①④ |
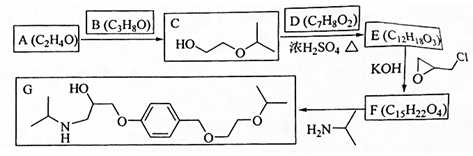
 .
.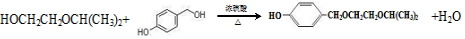 .
. 、
、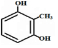 .
.