��Ŀ����
6����1�����������������漰���·�Ӧ����֪25�桢l0l kPaʱ��2SO2��g��+O2��g��+2H2O��l���T2H2SO4��l����H=-457kJ•mol-1
SO3��g��+H2O��l���TH2SO4��l����H=-130kJ•mol-1
��SO2��������Ӧ�У�ÿ����l mol SO3��g�����ʱ�Ϊ-98.5kJ•mol-1
�ټ�ͼ��SO2��������ӦʱSO2��g����SO3��g����Ũ����ʱ��ı仯�������Ӧ�ӿ�ʼ���ﵽƽ��ʱ����O2��ʾ��ƽ����Ӧ����Ϊ0.0375mol/��L��min����
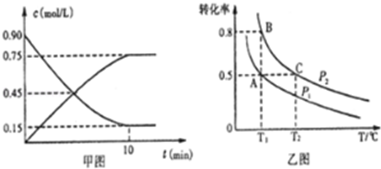
����һ�ݻ��ɱ�������г���20molSO2��g����l0molO2��g����O2��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ����ʾ����P1��P2�Ĵ�С��ϵ��P1�� P2�����=����A��B��C�����ƽ�ⳣ����С��ϵ��KA=KB��KC����KA��KB��KC�ͣ���=������ʾ����
��2��Ϊ�о�SO2������ʱ�¶ȶ�SO2ƽ��ת���ʵ�Ӱ�죬�����������飮ȡ100Lԭ�������������ΪSO27%��O2 11%��N282%��ʹ֮������Ӧ����10l kPa�´�ƽ�⣬���������ݣ�
| �¶�/�� | 500 | 525 | 550 | 575 | 600 |
| ƽ��ת����/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
��3���������ͬ���ʵ�����SO2��NH3����ˮ��������Ӧ�����ӷ���ʽΪSO2+NH3+H2O=NH4++HSO3-��������Һ��c��H+��-c��OH-��=cd������ţ���
a��c��SO32-��-c��H2SO3�� b��c��HSO3-��+c��SO32-��-c��NH4+��
c��c��SO32-��+c��NH3•H2O��-c��H2SO3�� d��c��HSO3-��+2c��SO32-��-c��NH4+��
�ڹ�ҵ����������ˮ�������Ṥҵ����������SO2��ļ�����Һ��������Cl2��β������������Cl2�����Һһ�����ڵ���������OH-��Cl-��SO42-��
���� ��1����֪���٣�2SO2��g��+O2��g��+2H2O��l���T2H2SO4��l����H=-457kJ•mol-1
�ڣ�SO3��g��+H2O��l���TH2SO4��l����H=-130kJ•mol-1
���ݸ�˹���ɣ���-2���ڿɵã�2SO2��g��+O2��g���T2SO3��g����H=-197kJ•mol-1����������ÿ����l mol SO3��g�����ʱ䣻
�ٸ���v=$\frac{��c}{��t}$ ����v��SO3��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��O2����
������ӦΪ���������С�ķ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ���������ת��������
ƽ�ⳣ��ֻ���¶�Ӱ�죬��ѹǿ�أ�����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С��
��2����϶��������ת���ʼ���ƽ��ʱ����ֵ��������������SO3�����������
��3����ͬ���ʵ�����SO2��NH3����ˮ��������Ӧ������������泥�
���ݵ���غ㣬��֪��c��H+��+c��NH4+��=c��HSO3-��+2c��SO32-��+c��OH-������Һ��������Դ��ˮ���롢HSO3-��ˮ�⡢NH4+��ˮ�⣬����������Դ��ˮ�ĵ��롢HSO3-��ˮ�⣬��ˮ����õ���cˮ��H+����cˮ��OH-����ȣ��ݴ��жϣ�
������Cl2�����Һ�Գ�ǿ���ԣ�˵���д���OH-�������ܽ������������Ϊ���������������ԭΪ�����ӣ�
��� �⣺��1����֪���٣�2SO2��g��+O2��g��+2H2O��l���T2H2SO4��l����H=-457kJ•mol-1
�ڣ�SO3��g��+H2O��l���TH2SO4��l����H=-130kJ•mol-1
���ݸ�˹���ɣ���-2���ڿɵã�2SO2��g��+O2��g���T2SO3��g����H=-197kJ•mol-1����ÿ����l mol SO3��g���ġ�H=��-197kJ•mol-1����$\frac{1}{2}$=-98.5kJ•mol-1��
�ʴ�Ϊ��-98.5��
��v��SO3��=$\frac{0.75mol/L}{10min}$=0.075mol/��L��min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��O2��=$\frac{1}{2}$v��SO3��=$\frac{1}{2}$��0.075mol/��L��min��=0.0375mol/��L��min����
�ʴ�Ϊ��0.0375mol/��L��min����
������ӦΪ���������С�ķ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ���������ת��������ѹǿP1��P2��
ƽ�ⳣ��ֻ���¶�Ӱ�죬��ѹǿ�أ�����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С����ƽ�ⳣ����KA=KB��KC��
�ʴ�Ϊ������KA=KB��KC��
��2���μӷ�Ӧ��������Ϊ��100L��7%��80%=5.6L��
2SO2��g��+O2��g���T2SO3��g��
��ʼ��L����7 11 0
ת����L����5.6 2.8 5.6
ƽ�⣨L����1.4 8.2 5.6
��ƽ��ʱSO3���������Ϊ $\frac{5.6L}{1.4L+8.2L+5.6L+100L��82%}$��100%��5.8%��
�ʴ�Ϊ��5.8��
��3����ͬ���ʵ�����SO2��NH3����ˮ��������Ӧ������������泥���Ӧ���ӷ���ʽΪ��SO2+NH3+H2O=NH4++HSO3-��
���ݵ���غ㣬��֪��c��H+��+c��NH4+��=c��HSO3-��+2c��SO32-��+c��OH-������c��H+��-c��OH-��=c��HSO3-��+2c��SO32-��-c��NH4+��
��Һ��������Դ��ˮ���롢HSO3-��ˮ�⡢NH4+��ˮ�⣬����������Դ��ˮ�ĵ��롢HSO3-��ˮ�⣬��ˮ����õ���cˮ��H+����cˮ��OH-����ȣ���c��H+��-c��OH-��=[c��SO32-��+c��NH3•H2O��+cˮ��H+��]-[c��H2SO3��+cˮ��OH-��]=c��SO32-��+c��NH3•H2O��-c��H2SO3������cd��ȷ��
�ʴ�Ϊ��SO2+NH3+H2O=NH4++HSO3-��cd��
������Cl2�����Һ�Գ�ǿ���ԣ�˵���д���OH-�������ܽ������������Ϊ���������������ԭΪ�����ӣ�������Cl2�����Һ��һ�����ڵ���������OH-��Cl-��SO42-��
�ʴ�Ϊ��Cl-��SO42-��
���� ���ⷴӦ���йؼ��㡢��Ӧ���ʼ��㡢��ѧƽ����㡢��ѧƽ��ͼ������Ũ�ȴ�С�Ƚϵȣ�����ƴ������Ŀ����4��������Ũ���ж�Ϊ�״��㡢�ѵ㣬ע�����õ���غ㡢������ˮ����з��������Ŀ�Ѷ��еȣ�

 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�| A�� | Cl2��FeBr2��Һ��Ӧ����n��Cl2����n��FeBr2��=1��1ʱ��2Fe2++4Br-+3Cl2�T2Fe2++2Br2+6Cl- | |
| B�� | NaOH��Һ��SO2��Ӧ����n��NaOH����n��SO2��=4��3ʱ��4OH-+3SO2�TSO32-+2HSO3-+H2O | |
| C�� | ��̪����̼������Һ�У���Һ��죺CO32-+H2O�THCO3-+OH- | |
| D�� | ������Ͷ��NaOH��Һ�У�Al+OH-+H2O�TAlO2-+H2�� |
| A�� | pH=1����Һ��Ag+��Al3+��Cl-��SO42- | |
| B�� | ��ʹ��̪��Һ������Һ��Na+��K+��HCO3-��S2- | |
| C�� | $\frac{c��O{H}^{-}��}{c��{H}^{+}��}$=10-12����Һ��NH4+��Cu2+��NO3-��Cl- | |
| D�� | ˮ���������c��OH-��=10-12 mol•L-1����Һ��K+��Fe2+��SO42-��NO3- |

| A�� | ͭƬ���淢��������Ӧ | B�� | ���Ӵ�ͭƬ����пƬ | ||
| C�� | ������пƬ����ͭƬ | D�� | пƬΪ����ͭƬΪ���� |
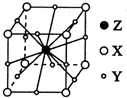 X��Y��Z��WΪ������Ԫ����ԭ��������������X��һ����̬�⻯��m���������ӻ��и�������Ҹ÷�������ԭ����һ��ֱ���ϣ�Y2-��M�ܲ��ԭ�ӹ��Ϊȫ��״̬��Z�ĵ����������ȷ�Ӧ����ȼ����������ZW2�ľ���Ϊ���Ӿ��壮 W��X�γɵĻ�������һ�ֳ������л��ܼ�n��AΪ��������Ԫ�أ����̬ԭ�Ӻ���6��δ�ɶԵ��ӣ�
X��Y��Z��WΪ������Ԫ����ԭ��������������X��һ����̬�⻯��m���������ӻ��и�������Ҹ÷�������ԭ����һ��ֱ���ϣ�Y2-��M�ܲ��ԭ�ӹ��Ϊȫ��״̬��Z�ĵ����������ȷ�Ӧ����ȼ����������ZW2�ľ���Ϊ���Ӿ��壮 W��X�γɵĻ�������һ�ֳ������л��ܼ�n��AΪ��������Ԫ�أ����̬ԭ�Ӻ���6��δ�ɶԵ��ӣ�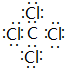
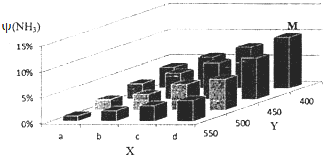 �ϳɰ��Ĺ�ҵ�������������������ʳ���⣬���ش�Ļ�ѧ�о��ɹ����ֽ�lmolN2��3molH2Ͷ��1L���ܱ���������һ�������£�����N2��g��+3H2��g��?2NH3��g����H��0��Ӧģ������ϳɰ��Ĺ�ҵ�����������ı�ijһ����������¶Ȼ�ѹǿ��ʱ��NH3����������ף�NH3���仯������ͼ��ʾ��
�ϳɰ��Ĺ�ҵ�������������������ʳ���⣬���ش�Ļ�ѧ�о��ɹ����ֽ�lmolN2��3molH2Ͷ��1L���ܱ���������һ�������£�����N2��g��+3H2��g��?2NH3��g����H��0��Ӧģ������ϳɰ��Ĺ�ҵ�����������ı�ijһ����������¶Ȼ�ѹǿ��ʱ��NH3����������ף�NH3���仯������ͼ��ʾ��