题目内容
16.工业废水中常含有一定量的Cr2O${\;}_{7}^{2-}$和CrO${\;}_{4}^{2-}$,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$CrO${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
方法1:还原沉淀法H+ ①Fe2+ ②OH-
该法的工艺流程为③
其中第①步存在平衡:2CrO${\;}_{4}^{2-}$(黄色)+2H+?CrO${\;}_{7}^{2-}$(橙色)+H2
(1)若平衡体系的pH=2,则溶液显色.
(2)第②步中,还原1mol Cr2O72-离子,需要mol 的FeSO4•7H2O.
(3)第③步生成的C r ( O H ) 3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH0)3的溶度积Ksp═10-32,要使Cr3+沉淀完全,溶液的pH 应调至.
方法2:电解法
该法用Fe 做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH
升高,产生Cr(OH)3沉淀.
(4)阴极的电极反应式为.
(5)写出溶液中另一个重要的氧化还原反应方程式..
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(2)根据氧化还原反应中得失电子守恒来计算;
(3)根据溶度积常数以及水的离子积常数来进行计算;
(4)阳极是活性电极时,阳极本身失电子,生成阳离子;
(5)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4•7H2O)×1,n(FeSO4•7H2O)=$\frac{1mol×6}{1}$=6mol,故答案为:6;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9 mol/L,c(H+)═$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5;
(4)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑,溶液酸性减弱;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-=H2↑,溶液酸性减弱;Fe(OH)3;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键.

| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| C. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 | |
| B. | 准确量取24.00 mL的液体可选用滴定管、量筒或滴定管 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,增大压强,平衡会正向移动,$\frac{{c}^{2}({SO}_{3})}{{c}^{2}({SO}_{2})•c{(O}_{2})}$ 的值增大 |
| A. | 及时除去二氧化碳,正反应速率加快 | |
| B. | 其它条件不变,加入催化剂,△H变大 | |
| C. | 增大压强,正反应速率增大,逆反应速率减小 | |
| D. | 降低温度,可提高反应物的转化率 |
| A. | SO2、O2完全转化为SO3 | B. | SO2、O2、SO3的浓度均不再变化 | ||
| C. | SO2、O2、SO3的浓度一定相等 | D. | 正、逆反应速率相等且等于零 |
| A. | Na+ | B. | Cl- | C. | HCO3- | D. | Fe2+ |
2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化反应中,每生成l mol SO3(g)的焓变为-98.5kJ•mol-1
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为0.0375mol/(L.min).
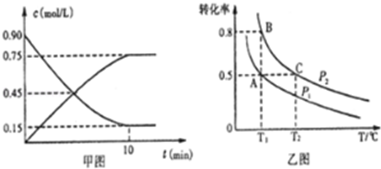
②在一容积可变的容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1< P2(填>、=或<);A、B、C三点的平衡常数大小关系是KA=KB>KC(用KA、KB、KC和>、=、<表示).
(2)为研究SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO27%、O2 11%、N282%)使之发生反应,在10l kPa下达平衡,得以下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(3)①如果相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为SO2+NH3+H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=cd(填序号).
a.c(SO32-)-c(H2SO3) b.c(HSO3-)+c(SO32-)-c(NH4+)
c.c(SO32-)+c(NH3•H2O)-c(H2SO3) d.c(HSO3-)+2c(SO32-)-c(NH4+)
②工业上用足量氨水吸收硫酸工业废气,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液一定存在的阴离子有OH-和Cl-、SO42-.
 b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( ) ===CO2↑+H2O
===CO2↑+H2O +OH―
+OH― NH3↑+H2O
NH3↑+H2O