题目内容
11.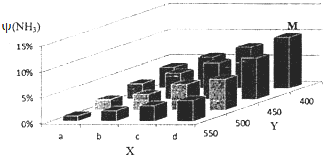 合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.回答下列问题:
(1)已知:
①NH3(I)?NH3(g)△H1
②N2(g)+3H2(g)?2NH3(I)△H2
则反应N2(g)+3H2(g)?2NH3(g)的△H=2△H1+△H2(用含△H1、△H2的代数式表示).
(2)合成氨的平衡常数表达式为K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,平衡时,M点NH3的体积分数为10%,则N2的转化率为18%(保留两位有效数字).
(3)图中,Y轴表示温度(填“温度”或“压强”),判断的理由是随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,故Y为温度.
(4)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y203)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-.写出负极的电极反应式2NH3+3O2--6e-=N2+3H2O.
分析 (1)根据盖斯定律,①×2+②可得③,反应热也进行相应计算;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;设转化的氮气为xmol,表示出平衡时各物质的物质的量,再根据M点NH3的体积分数为10%列方程计算解答;
(3)随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动,φ(NH3)增大;
(4)原电池负极发生氧化反应,氨气在负极失去电子,与电解质氧化传导的O2-结合生成氮气与水.
解答 解:(1)已知:①NH3(l)?NH3(g)△H1
②N2(g)+3H2(g)?2NH3(l)△H2
根据盖斯定律,①×2+②可得:N2(g)+3H2(g)?2NH3(g),故△H=2△H1+△H2,
故答案为:2△H1+△H2;
(2)反应N2(g)+3H2(g)?2NH3(g)的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
设转化的氮气为xmol,则:N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
转化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=10%,解得x=$\frac{2}{11}$mol,故氮气转化率为$\frac{\frac{2}{11}mol}{1mol}$×100%=18%,
故答案为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;18%;
(3)随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动;
故答案为:温度;随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,故Y为温度;
(4)原电池负极发生氧化反应,氨气在负极失去电子,与电解质氧化传导的O2-结合生成氮气与水,负极电极反应式为:2NH3+3O2--6e-=N2+3H2O,
故答案为:2NH3+3O2--6e-=N2+3H2O.
点评 本题考查化学平衡计算与影响因素、反应热计算、原电池等,题目比较综合,需要学生具备扎实的基础与灵活应用能力,难度中等.

 计算高手系列答案
计算高手系列答案| A. | 及时除去二氧化碳,正反应速率加快 | |
| B. | 其它条件不变,加入催化剂,△H变大 | |
| C. | 增大压强,正反应速率增大,逆反应速率减小 | |
| D. | 降低温度,可提高反应物的转化率 |
| A. | 用加热法除去NaOH固体中混有的NH4Cl固体. | |
| B. | 向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 | |
| C. | SO2能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| D. | 向水玻璃中滴加盐酸制备硅酸 |
| A. | 18,18 | B. | 18g,18g | C. | 18g/mol,18g | D. | 18g,18g/mol |
2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化反应中,每生成l mol SO3(g)的焓变为-98.5kJ•mol-1
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为0.0375mol/(L.min).
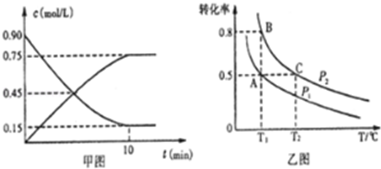
②在一容积可变的容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1< P2(填>、=或<);A、B、C三点的平衡常数大小关系是KA=KB>KC(用KA、KB、KC和>、=、<表示).
(2)为研究SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO27%、O2 11%、N282%)使之发生反应,在10l kPa下达平衡,得以下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(3)①如果相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为SO2+NH3+H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=cd(填序号).
a.c(SO32-)-c(H2SO3) b.c(HSO3-)+c(SO32-)-c(NH4+)
c.c(SO32-)+c(NH3•H2O)-c(H2SO3) d.c(HSO3-)+2c(SO32-)-c(NH4+)
②工业上用足量氨水吸收硫酸工业废气,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液一定存在的阴离子有OH-和Cl-、SO42-.
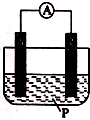 如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 锌 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
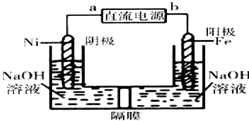 运用化学原理知识研究化学对于人类的生产生活、科研意义重大.
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.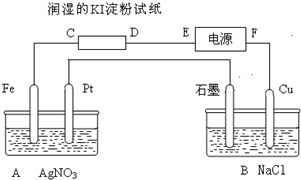 有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:
有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答: