题目内容
2.将一定量的碳酸钠和碳酸氢钠的混合物27.4g,跟含溶质0.4mol的盐酸恰好反应,生成二氧化碳气体.(已知碳酸氢钠和盐酸反应的方程式如下:NaHCO3+HCl→NaCl+CO2↑+H2O )
(1)写出碳酸钠与盐酸反应的化学方程式
(2)求原混合物中碳酸钠和碳酸氢钠的质量各多少克?
(3)求生成的二氧化碳气体在标准状况下的体积.
分析 (1)碳酸钠与盐酸反应生成氯化钠、二氧化碳气体和水;
(2)设出混合物中含有碳酸钠、碳酸氢钠的物质的量,然后分别根据总质量、消耗氯化氢的物质的量列式计算;
(3)根据碳原子守恒计算出生成二氧化碳的物质的量,然后根据V=nVm计算出生成二氧化碳的体积.
解答 解:(1)碳酸钠与盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为:Na2CO3+2HCl→2NaCl+CO2↑+H2O,
答:碳酸钠与盐酸反应的化学方程式为Na2CO3+2HCl→2NaCl+CO2↑+H2O;
(2)设原混合物中含有碳酸钠、碳酸氢钠的物质的量分别为x、y,
则$\left\{\begin{array}{l}{106x+84y=27.4}\\{2x+y=0.4}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.1mol}\\{0.2mol}\end{array}\right.$,
原混合物中含有碳酸钠的质量为:106g/mol×0.1mol=10.6g,含有碳酸氢钠的质量为:84g/mol×0.02mol=16.8g,
答:原混合物中含有碳酸Na2CO3的质量为10.6g,NaHCO3为16.8g;
(3)碳酸钠、碳酸氢钠与盐酸反应生成二氧化碳气体,根据C原子守恒可知生成二氧化碳的物质的量为:0.1mol+0.2mol=0.3mol,
标准状况下0.3mol二氧化碳的体积为:22.4L/mol×0.3mol=6.72L,
答:生成二氧化碳在标准状况下的体积为6.72L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
12.在某无色透明的酸性溶液中,能共存的离子组是( )
| A. | Mg2+、SO42-、K+、Cl- | B. | Na+、NH4+、NO3-、Fe3+ | ||
| C. | K+、CO32-、Cl-、Br- | D. | Ba2+、Na+、OH-、SO42- |
13.某工业废料中主要含有Al2O3、Co2O3•CoO、少量Fe3O4等金属氧化物(Co2O3•CoO不与强碱反应).实验室科技人员欲将之分离并制备相关物质,设计流程如下:
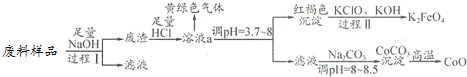
(1)过程Ⅰ中的操作名称是过滤,写出过程Ⅰ发生反应的化学方程式Al2O3+2NaOH═2NaAlO2+H2O.
(2)溶液a中含有金属离子有Co2+、Fe3+.
(3)溶液a中逸出的黄绿色气体是氯气,下列说法不正确的是①、④.
①氯气是有漂白性的酸性气体
②液氯和氯水均为液体,且都含有氯分子
③将氯气通入碱液时,氯气既是氧化剂,又是还原剂
④次氯酸见光易分解,说明次氯酸是弱酸
⑤向氯水中滴硝酸银溶液,有白色沉淀生成,说明氯水中含Cl-
(4)写出过程Ⅱ发生反应的离子方程式:2Fe(OH)3+3ClO-+4OH-═2FeO42-+5H2O+3Cl-.
高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH
则充电时阳极反应式为Fe(OH)3-3e-+5OH-═FeO42-+4H2O.
(5)Co可以形成CoC2O4•2H2O(M为183g/mol),5.49g该晶体在空气中加热,在不同温度下分别得到一种固体物质,其质量如表:
经测定,210℃~290℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为:3CoC2O4+2O2$\frac{\underline{\;210℃~290℃\;}}{\;}$Co3O4+6CO2.

(1)过程Ⅰ中的操作名称是过滤,写出过程Ⅰ发生反应的化学方程式Al2O3+2NaOH═2NaAlO2+H2O.
(2)溶液a中含有金属离子有Co2+、Fe3+.
(3)溶液a中逸出的黄绿色气体是氯气,下列说法不正确的是①、④.
①氯气是有漂白性的酸性气体
②液氯和氯水均为液体,且都含有氯分子
③将氯气通入碱液时,氯气既是氧化剂,又是还原剂
④次氯酸见光易分解,说明次氯酸是弱酸
⑤向氯水中滴硝酸银溶液,有白色沉淀生成,说明氯水中含Cl-
(4)写出过程Ⅱ发生反应的离子方程式:2Fe(OH)3+3ClO-+4OH-═2FeO42-+5H2O+3Cl-.
高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH
则充电时阳极反应式为Fe(OH)3-3e-+5OH-═FeO42-+4H2O.
(5)Co可以形成CoC2O4•2H2O(M为183g/mol),5.49g该晶体在空气中加热,在不同温度下分别得到一种固体物质,其质量如表:
| 温度范围(℃) | 固体质量(g) |
| 150-210 | 4.41 |
| 290-320 | 2.41 |
| 890-920 | 2.25 |
7.下列说法中正确的是( )
| A. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| B. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| C. | 用氢氧焰可以加热软化玻璃制玻璃器皿,这利用了氢气和氧气化合时放出的热量 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
14.下列说法正确的是( )
| A. | 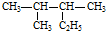 按系统命名法的名称为:2-甲基-3-乙基丁烷 按系统命名法的名称为:2-甲基-3-乙基丁烷 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白纤维 | |
| D. | 等质量的甲醛、葡萄糖、纤维素完全燃烧时的耗氧量相等 |
11.下列叙述中正确的是( )
| A. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| B. | 用硝酸酸化的硝酸银溶液能一次鉴别NaCl,NaBr,KI三种失去标签的溶液 | |
| C. | 某溶液中加入CCl4,CC14层显紫色,证明原溶液中存在I- | |
| D. | 某浅黄色的溴水,加入CC14震荡静置后,上层显橙红色 |