题目内容
下列有关叙述不正确的是( )
| A、若根据反应“H2+Cl2=2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸 |
| B、氯气溶于水达到平衡后,若其他条件不变,加入少量水,水的电离平衡向正向移动 |
| C、25℃时,任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×10-14 mol2?L-2 |
| D、冰醋酸中逐滴加水,则溶液的导电性先增大后减小 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.能自发进行的放热的氧化还原反应能设计成原电池反应;
B.氯气溶于水生成HCl和HClO,加水稀释,溶液中c(H+)减小,抑制水电离程度减小;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,离子积常数只与温度有关;
D.溶液导电能力与离子浓度成正比.
B.氯气溶于水生成HCl和HClO,加水稀释,溶液中c(H+)减小,抑制水电离程度减小;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,离子积常数只与温度有关;
D.溶液导电能力与离子浓度成正比.
解答:
解:A.该反应能自发进行且是放热的氧化还原反应,所以能设计成原电池,该反应能生成HCl,从而制备盐酸,故A正确;
B.氯气溶于水生成HCl和HClO,加水稀释,溶液中c(H+)减小,抑制水电离程度减小,所以水的电离平衡向正向移动,故B正确;
C.水的离子积常数只与温度有关,温度一定,水的离子积常数一定,但酸或碱抑制水电离,含有弱离子的盐促进水电离,所以电解质溶液中水电离出的c(H+)和c(OH-)的乘积与电解质有关,故C错误;
D.溶液导电能力与离子浓度成正比,冰醋酸中加入水,溶液中氢离子浓度先增大后减小,所以溶液导电能力先增大后减小,故D正确;
故选C.
B.氯气溶于水生成HCl和HClO,加水稀释,溶液中c(H+)减小,抑制水电离程度减小,所以水的电离平衡向正向移动,故B正确;
C.水的离子积常数只与温度有关,温度一定,水的离子积常数一定,但酸或碱抑制水电离,含有弱离子的盐促进水电离,所以电解质溶液中水电离出的c(H+)和c(OH-)的乘积与电解质有关,故C错误;
D.溶液导电能力与离子浓度成正比,冰醋酸中加入水,溶液中氢离子浓度先增大后减小,所以溶液导电能力先增大后减小,故D正确;
故选C.
点评:本题考查弱电解质的电离、溶液导电性等知识点,侧重考查学生分析问题、解答问题能力,易错选项是CD,注意:一定温度下,酸、碱或含有弱离子的盐影响水电离出的c(H+)和c(OH-)的乘积,但不影响溶液中c(H+)和c(OH-)的乘积,二者易混淆,为易错点.

练习册系列答案
相关题目
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,则( )
| A、原子半径:x>y |
| B、电负性:x>y |
| C、离子半径:x<y |
| D、第一电离:x<y |
下列试剂的保存不正确的是( )
| A、漂白粉必须密封保存 |
| B、新制氯水用无色的广口瓶保存 |
| C、少量金属钠保存在煤油中 |
| D、液溴用一层水封盖再密封保存 |
化学与生产生活密切相关.下列说法中,正确的是( )
| A、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
| B、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
C、使用聚乙烯塑料制品比使用聚乳酸 (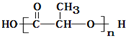 )塑料制品更环保 )塑料制品更环保 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对环境保护、节能减排具有重要意义 |
最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4?5H2O.实验结果如下下列关于这一过程的叙述错误的是( )
| 沸腾炉炉度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生成物 | 水溶性Cu% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |
| A、反应中有二氧化硫生成 |
| B、产物中铜元素主要以氧化物形式存在 |
| C、随温度升高,铁的氧化物在酸中的溶解度降低 |
| D、温度高于600~620℃生成物中水溶性Cu(%)下降的原因是水溶性铜分解所致 |
下列事实不能用勒沙特列原理(化学平衡移动原理)解释的是( )
| A、N2+3H2?2NH3△H<0;工业上采用20MPa至50MPa的高压条件 | ||||||||
B、
| ||||||||
C、 | ||||||||
D、
|
沸腾时只需克服范德华力的液体物质是( )
| A、水 | B、酒精 | C、溴 | D、水银 |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、AlCl3溶液中加入足量的NaOH溶液:Al3++3OH-═Al(OH)3↓ |
