题目内容
14.标准状况下,将5.6L由CO、CH4、C2H4、C2H2组成的混合气体与18L O2混合于某密闭容器中点燃,反应完成后再恢复到原状况,得CO2气体7.50L,则下列判断正确的是( )| A. | 原混合气体中CO与CH4的体积分数和为33.9% | |
| B. | 原混合气体中,C2H4与C2H2的体积共为1.9L | |
| C. | 反应完成后,生成水的质量为9g | |
| D. | 原混合气体中,CO与CH4的体积比一定为1:1 |
分析 A.根据C原子守恒,二氧化碳比原气体增大的体积即为乙烯和乙炔的体积,则生成二氧化碳体积比混合物体积增大了:7.5L-5.6L=1.9L,所以乙烯和乙炔的总体积为1.9L,所以CO与CH4的体积为5.6L-1.9L=3.7L;
B.根据生成二氧化碳的体积判断乙烯和乙炔的总体积;
C.题中数据无法判断甲烷、乙烯和乙炔的体积,则无法计算水的物质的量、质量;
D.能够计算出CO和甲烷的总体积,但是无法计算二者的具体体积.
解答 解:A.根据C原子守恒,二氧化碳比原气体增大的体积即为乙烯和乙炔的体积,则生成二氧化碳体积比混合物体积增大了:7.5L-5.6L=1.9L,所以乙烯和乙炔的总体积为1.9L,所以CO与CH4的体积为5.6L-1.9L=3.7L,所以混合气体中CO与CH4的体积分数和为$\frac{3.7L}{5.6L}×100%$=66.1%,故A错误;
B.根据C原子守恒,二氧化碳比原气体增大的体积即为乙烯和乙炔的体积,则生成二氧化碳体积比混合物体积增大了:7.5L-5.6L=1.9L,所以乙烯和乙炔的总体积为1.9L,故B正确;
C.题干信息无法判断CH4、C2H4、C2H2的体积,则无法计算反应后生成水的物质的量,故C错误;
D.根据B可知,混合气体中CO和甲烷的总体积为:5.6L-1.9L=3.7L,但是题中数据无法计算一氧化碳和甲烷的具体体积,故D错误;
故选B.
点评 本题考查混合物的有关计算,为高频考点,采用极限法、差量法来分析解答即可,侧重考查学生分析计算能力,题目难度中等.

练习册系列答案
相关题目
2.常温常压下,amL三种气态烃以任意比混合后,和足量O2混合点燃,恢复到原状态后,测得气体体积共缩小 2amL( 不考虑CO2的溶解).则三种烃可能的组合( )
| A. | C3H8、C4H4、C4H6 | B. | CH4、C3H6、C2H2 | C. | C2H6、C3H4、C4H6 | D. | C2H4、CH4、C3H4 |
9.某有机化合物3.1g完全燃烧生成4.4g CO2和2.7gH2O,无其它物质生成.下列说法正确的是( )
| A. | 该化合物肯定含O元素 | B. | 该化合物属于烃 | ||
| C. | 该化合物的相对分子质量肯定为3l | D. | 该化合物的结构只有一种 |
19.下列化学用语表达正确的是( )
| A. | 一氯甲烷的结构式CH3Cl | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 氯化铵的电子式 | D. | 苯的分子式 |
6.现有反应 3Fe(s,粉末)+4H2O(g)$\stackrel{△}{?}$Fe3O4(s)+4H2(g),采取下列措施可以改变反应速率的是( )
| A. | 增加Fe粉的用量 | |
| B. | 充入Ar,保持容器内体积不变 | |
| C. | 保持容器体积不变,增加水蒸气输入量 | |
| D. | 充入Ar,保持容器内压强不变 |
3.将8.0克Fe和CuO的混合物投入300mL 2mol/L硝酸中,反应完全后生成2.24LNO(标准状况下测得),再向反应后的溶液中加入2mol/L NaOH溶液,要使所有金属元素完全沉淀下来,所加入NaOH溶液的体积最少需要( )
| A. | 250mL | B. | 200 mL | C. | 100 mL | D. | 不能确定 |
20.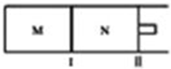 如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
 如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<3,C的平衡浓度关系为:c(M)<c(N) | |
| C. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) | |
| D. | x不论为何值,平衡时M、N中的平均相对分子质量都相等 |

 .
. .
.