题目内容
17.向溶液中加入新物质时,其导电性(I)符合图变化趋势的实验操作是( )
| A. | 乙酸溶液中通入氨气至过量 | B. | 石灰水中通入CO2至过量 | ||
| C. | 亚硫酸中通入氯气至过量 | D. | 氨水中通入氯化氢气体 |
分析 依据图象分析随加入物质的增多导电能力减弱到最小,说明加入物质反应,使溶液中的离子浓度减少,继续加入导电能力增强,说明加入的物质会使溶液中离子浓度增多分析.
解答 解:A、乙酸溶液中通入氨气至过量,发生反应是弱电解质醋酸与氨水反应生成了醋酸铵是强电解质,所以导电能力会增强,故A错误;
B、石灰水中通入CO2至过量,石灰水中的氢氧化钙是强电解质,随着二氧化碳的通入生成碳酸钙沉淀和水,离子浓度减少,导电能力减弱,恰好转化为碳酸钙和水,导电能力最小,继续通入二氧化碳会和水、碳酸钙反应生成碳酸氢钙强电解质,所以得到能力又增强,故B正确;
C、氢硫酸中通入氯气至过量,硫化氢是弱电解质,通入氯气会反应生成硫酸和盐酸都是强电解质,所以导电能力随着氯气通入增强,故C错误;
D、氨水是弱电解质,导电能力弱,氨水中通入氯化氢气体,生成强电解质氯化铵,所以得到能力是增强的,故D错误;
故选:B.
点评 本题考查了溶液得到能力的原因,强弱电解质的判断,关键是反应过程中生成物质的性质判断.

练习册系列答案
相关题目
7.化学与社会、生产、生活密切相关,下列说法正确的是( )
| A. | 鲜花运输途中需喷洒高锰酸钾稀溶液,主要是为鲜花补充钾肥 | |
| B. | 牙膏中添加的Na3PO3F、NaF提供的氟离子浓度相等时,它们防治龋齿的作用相同 | |
| C. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2均能代替明矾净水 | |
| D. | 用石灰水或Na2SiO3溶液喷涂在树干上均可消灭树皮上的过冬虫卵 |
5.下列反应的离子方程式正确的是( )
| A. | 实验室用大理石和稀盐酸制取二氧化碳:2H++CO32-→CO2↑+H2O | |
| B. | 铁片溶于稀硫酸中:2Fe+6H+→2Fe3++3H2↑ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-→Al(OH)3↓ | |
| D. | 氢氧化铜溶于稀盐酸中:Cu(OH)2+2H+→2H2O+Cu2+ |
12.我国油气资源匮乏而煤储量相对丰富.将煤转化为水煤气(CO、H2),不可能产生的效果是( )
| A. | 得到相对清洁的能源 | B. | 提高了能源利用率 | ||
| C. | 增加了单位质量煤的热值 | D. | 便于管道输送 |
2.已知常温下0.1mol•L-1NH4HCO3溶液的pH=7.8,溶液中含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )


| A. | 常温下,碳酸的第一、二步电离常数之比为K1:K2=102.9 | |
| B. | NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | NH4HCO3溶液中:c(NH4+)+c(NH3•H2O)+c(H+)=c(CO32-)+c(H2CO3)+c(HCO3-)+c(OH-) | |
| D. | 常温下,NH3•H2O的电离常数大于H2CO3的第一步电离常数 |
7.在容积不变的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),反应达平衡状态的标志是( )
①单位时间内生成n mol N2的同时生成2n mol NH3
②用N2、H2、NH3的物质的量浓度变化表示的反应速率比为1:3:2的状态
③2v(H2)正=3v(NH3)逆
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
①单位时间内生成n mol N2的同时生成2n mol NH3
②用N2、H2、NH3的物质的量浓度变化表示的反应速率比为1:3:2的状态
③2v(H2)正=3v(NH3)逆
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A. | ①③④ | B. | ②③⑤ | C. | ①③⑤ | D. | ①②③④⑤ |
5.下列化学用语正确的是( )
| A. | 丙烯的实验式:C3H6 | B. | CO2的电子式: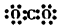 | ||
| C. | 镁离子的结构示意图: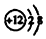 | D. | 中子数为18 的氯原子符号:1718Cl |

 .
.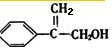 .写出反应⑥的化学方程式(注明必要的反应条件):
.写出反应⑥的化学方程式(注明必要的反应条件): +CH3OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3OH$→_{△}^{浓H_{2}SO_{4}}$ .
.