题目内容
8.下列比较正确的是( )| A. | 原子半径大小:Mg>S>O>F | |
| B. | 单质与氢气化合容易度:P>S>Cl | |
| C. | 分散质微粒直径大小:Fe(OH)3胶体>CaCO3悬浊液>NaCl溶液 | |
| D. | 酸性强弱:H2SO4<H3PO4<H2SiO3 |
分析 A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小;
B.非金属性越强,与氢化合越容易;
C.悬浊液中微粒的直径大于胶体粒子的直径;
D.非金属性越强,最高价氧化物对应水合物的酸性越强.
解答 解:A.Mg、S含有3个电子层,O、F含有2个电子层,则Mg、S的原子半径大于O、F,结合原子序数Mg<S、O<F可知原子半径大小为:Mg>S>O>F,故A正确;
B.非金属性P<S<Cl,则单质与氢气化合容易度为:P<S<Cl,故B错误;
C.分散质微粒中,悬浊液的粒子直径最大,其次为胶体,溶液最小,所以分散质微粒直径大小为:CaCO3悬浊液>Fe(OH)3胶体>NaCl溶液,故C错误;
D.非金属性S<P<Si,最高价含氧酸的酸性强弱为:H2SO4>H3PO4>H2SiO3,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的关系、分散系分类及性质,题目难度不大,明确元素周期律内容为解答关键,注意掌握分散系的分类依据,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
17.下列说法正确的是( )
| A. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2-3次 | |
| B. | 向酒精灯内添加酒精时,不能多于容积的$\frac{2}{3}$,若不慎洒出的酒精在桌上燃烧,应迅速用水灭火 | |
| C. | 探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合 | |
| D. | 配制浓硫酸和浓硝酸的混合酸时,将浓硝酸沿器壁慢慢加入浓硫酸中,并不断搅拌 |
3.某同学进行中和反应实验:取适量的NaOH溶液于烧杯中,滴加几滴紫色石蕊试液.再逐渐滴加稀H2SO4测得溶液的pH及颜色变化情况如表:
(1)图中符合上述实验过程的图形是C
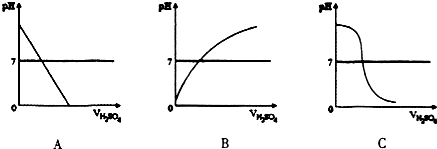
(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
| 滴加稀H2SO4的体积ml | O | l | 2 | 3 | 4 | 5 | 6 | 7 |
| pH | 13.0 | 12.8 | 12.5 | 12.2 | 7.0 | 2.0 | 1.7 | 1.6 |
| 溶液颜色 | 蓝色 | 紫色 | 红色 | |||||

(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
17.根据表提供的数据,下列判断正确的是( )
| 化学式 | 电离常数 |
| HF | Ki=3.5×10-4 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 | |
| HClO | Ki=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO->HCO3->F- | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O→HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF→2F-+H2O+CO2↑ |
18.下列说法正确的是( )
| A. | NH3、CO、CO2都是极性分子 | |
| B. | H2O、D2O、T2O互为同分异构体 | |
| C. | CH4、CCl4都是含有极性键的非极性分子 | |
| D. | HF、HCl、HBr、HI的稳定性依次增强 |