题目内容
15.下列依据相关实验得出的结论正确的是( )| A. | 向某溶液中加入先加氯水,再加KSCN溶液后显红色,该溶液中一定含Fe2+ | |
| B. | 向某溶液中加入硝酸酸化的硝酸银溶液,出现白色沉淀,该溶液中一定含Cl- | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,该溶液中一定含SO42- | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液中一定含CO32- |
分析 A.加入试剂顺序错误,应该先加入硫氰化钾溶液,然后再加入氯水;
B.AgCl不溶于硝酸;
C.可能生成AgCl沉淀;
D.二氧化碳和二氧化硫气体都能够澄清石灰水变浑浊.
解答 解:A.向某溶液中先加KSCN溶液,溶液没有明显变化,然后再加入氯水,若溶液呈血红色,则原溶液中定含Fe2+,故A错误;
B.AgCl不溶于硝酸,加入硝酸酸化的硝酸银溶液,出现白色沉淀,可说明该溶液中一定含Cl-,故B正确;
C.可能生成AgCl沉淀,应先加盐酸,如无现象再加入氯化钡检验,故C错误;
D.向某溶液中加入稀盐酸,若产生的气体使澄清石灰水变浑浊,该气体可能为二氧化碳或二氧化硫,溶液中可能含有亚硫酸根离子、碳酸氢根离子等,不一定含有CO32-,故D错误.
故选B.
点评 本题考查了实验方案的评价,题目难度不大,涉及阴阳离子检验、浓硫酸和浓盐酸的性质,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
6.在强酸性的无色溶液中能大量共存的离子组是( )
| A. | Ba2+、K+、OH-、NO3- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CO32- |
3.下列说法正确的是( )
| A. | 凡pH<7的雨水就可看作“酸雨” | |
| B. | 燃烧不一定要有氧气的参加,但燃烧一定是氧化还原反应 | |
| C. | 用NaClO溶液代替Cl2作为漂白剂是由于它难分解且在空气中可转化为HClO | |
| D. | 玻璃是氧化物,成分可表示为Na2OCaO•6SiO2 |
10.向含有Na+、NH4+、Al3+、Fe2+的溶液中,加入足量的NaOH溶液以后,微热并拌;然后加入足量的盐酸,溶液中离子的数目保持不变的是( )
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Na+ |
7.将一小快钠下列溶液时,既能产生气体最终又有白色沉淀的是( )
| A. | 氯化亚铁溶液 | B. | 氢氧化钠稀溶液 | C. | 硫酸铜溶液 | D. | 氯化镁溶液 |
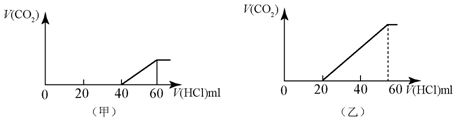
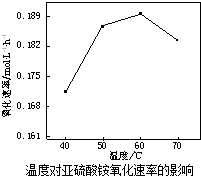 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: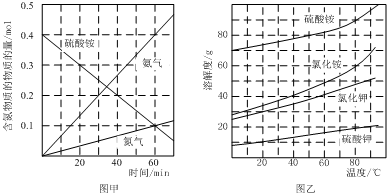
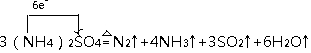 .
.