题目内容
17.下列实验方案设计不合理的是( )
| A. | 图1:验证苯中是否有碳碳双键 | |
| B. | 图2:验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 图3:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 图4:验证酸性CH3COOH>H2CO3>C6H5OH |
分析 A.苯与溴水、高锰酸钾均不反应;
B.加热时碳酸钠不易分解、碳酸氢钠易分解;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
D.强酸能和弱酸盐反应生成弱酸.
解答 解:A.苯与溴水、高锰酸钾均不反应,可验证苯中不含有碳碳双键,故A正确;
B.加热时碳酸钠不易分解、碳酸氢钠易分解,要验证NaHCO3和Na2CO3的热稳定性,如果碳酸钠的受热温度高于碳酸氢钠的受热温度,且左边烧杯中不产生白色沉淀、右边烧杯中产生白色沉淀就能验证NaHCO3和Na2CO3的热稳定性,故B正确;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,干扰乙烯的检验,可以用溴水检验生成的乙烯,故C错误;
D.强酸能和弱酸盐反应生成弱酸,乙酸和碳酸钠反应生成二氧化碳且放出热量,导致生成的二氧化碳中含有乙酸,为防止干扰,应该除去乙酸,二氧化碳、水和硅酸钠反应生成白色沉淀硅酸,所以该实验能验证酸性CH3COOH>H2CO3>C6H5OH,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及酸性强弱判断、物质检验、物质稳定性检验、化学键判断等知识点,明确实验原理、物质性质及其差异性是解本题关键,注意物质检验时要排除其它物质的干扰,易错选项是C.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
8.分子式为C9H12的芳香烃的苯环上的一氯代物的数目为( )
| A. | 8种 | B. | 16种 | C. | 22种 | D. | 24种 |
5.酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O.
(2)滴定过程中操作滴定管的图示1正确的是A.
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度偏高(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
(4)写出表中a 对应的实验目的探究温度不同对反应速率的影响;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图2.

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论.甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间.
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O.
(2)滴定过程中操作滴定管的图示1正确的是A.
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度偏高(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 试验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响 b.实验1和3探究反应物浓度对该反应速率的影响. c.实验2和4探究催化剂对反应速率的影响 | |
| 体积(mL) | 浓度(mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 试验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
12.铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如图:
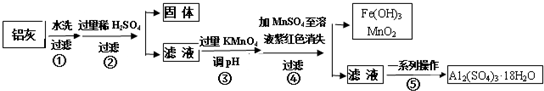
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去;若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤PH<3.4.
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.

请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
2.下列有关说法错误的是( )
| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
 ,D
,D ,E
,E .
.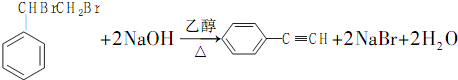 .
.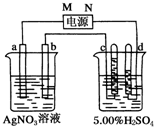 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.