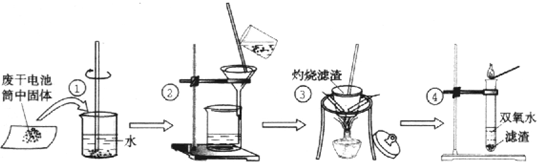
题目内容
9.表中第Ⅰ中的现象与第Ⅱ中解释或发生反应的方程式(或离子方程式)不相符合的是( )| Ⅰ | Ⅱ | |
| A | 在淀粉KI试纸上滴几滴的FeCl3溶液,试纸变蓝 | 2Fe3++2I-=I2+2Fe2+ |
| B | 铝条置于火焰加热,看到铝熔化欲滴落,却又很快凝固 | 加热时,与O2发生反应,反应吸热 |
| C | 钠投到煤油和水的混合物中,钠粒在分界处作跳动和游动 | 钠的密度比水小比煤油大,能与水反应产生H2 |
| D | 一试管内有2V的Cl2,倒置于水中,在强光充分照射,最后试管中气体变为无色,体积为V | 因为反应Cl2+H2O?HCl+HClO 和2HClO$\stackrel{光照}{?}$2HCl+O2↑ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.三价铁离子具有强氧化性能够氧化碘离子生成单质碘;
B.铝与氧气反应生成氧化铝,为放热反应;
C.钠密度小于水,大于煤油,与水反应生成氢气;
D.氯气与水反应生成氯化氢和次氯酸,次氯酸分解生成氯化氢和氧气.
解答 解:A.在淀粉KI试纸上滴几滴的FeCl3溶液,试纸变蓝,离子方程式:2Fe3++2I-=I2+2Fe2+,故A正确;
B.铝条置于火焰加热,发生铝与氧气反应生成氧化铝,该反应为放热反应,生成的氧化铝熔点高,所以看到铝熔化欲滴落,却又很快凝固,故B错误;
C.钠密度小于水,大于煤油,与水反应生成氢气,所以钠投到煤油和水的混合物中,钠粒在分界处作跳动和游动,故C正确;
D.氯气与水反应生成氯化氢和次氯酸,次氯酸分解生成氯化氢和氧气,反应方程式:Cl2+H2O?HCl+HClO和2HClO$\stackrel{光照}{?}$2HCl+O2↑,所以一试管内有2V的Cl2,倒置于水中,在强光充分照射,最后试管中气体变为无色,体积为V,故D正确;
故选:B.
点评 本题考查了化学方程式、离子方程式书写,明确反应实质是解题关键,注意氧化铝熔点高,题目难度中等.

练习册系列答案
相关题目
19.位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族,D、E同周期.A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18.F是其所在周期中最活泼的金属元素.根据推断回答下列问题:
(1)A在周期表中的位置第二周期、ⅤA族:写出D与F形成的最简单离子化合物的电子式K+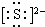 K+.
K+.
(2)用“>”或“<”填空:
(3)一定条件,在水溶液中1mol E-、EBx-(x=1,2,3,4)的能量(KJ)相对大小如图所示.
①d点对应的微粒是ClO4-(填离子符号)
②b→a+c反应的离子方程式为3ClO-=ClO3-+2Cl-,该反应是放热反应(填“吸热”或“放热”)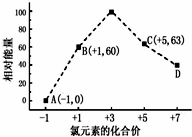
(1)A在周期表中的位置第二周期、ⅤA族:写出D与F形成的最简单离子化合物的电子式K+
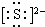 K+.
K+.(2)用“>”或“<”填空:
| 离子半径 | 非金属性 | 酸性 | 沸点 |
| F+<D2- | A<B | D的最高价氧化物的水化物<E的最高价氧化物的水化物 | C的氢化物>E的氢化物 |
①d点对应的微粒是ClO4-(填离子符号)
②b→a+c反应的离子方程式为3ClO-=ClO3-+2Cl-,该反应是放热反应(填“吸热”或“放热”)

4.“市民利益无小事,食品安全是大事”,袋装食品更受各部门的关注,为了延长食品的保质期,在袋装食品的袋中往往放入一小包上面标有“不可食用”的字,则这包中装的物质可能是( )
| A. | 食盐和味精 | B. | 味精和糖 | C. | 铁粉和硅胶 | D. | 铁粉和碱石灰 |
14.下列关于物质的保存的叙述正确的是( )
| A. | 氯水保存在棕色剂瓶中,碘保存在配有铁盖的试剂瓶中 | |
| B. | 在配制和贮存FeCl3溶液时,要加入少量铁粉,以防在空气中变质 | |
| C. | 烧碱、纯碱等碱性溶液应保存在配有玻璃塞的试剂瓶中 | |
| D. | 漂白粉、烧碱、Na2SiO3均要密封保存 |
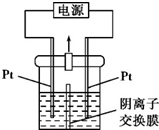 某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
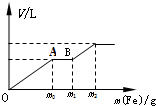 往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示
往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示