题目内容
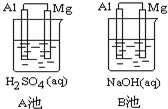 Al-Mg在不同的电解质溶液中分别构成原电池A、B.如图所示:
Al-Mg在不同的电解质溶液中分别构成原电池A、B.如图所示:指出各池中的负极材料并写出其电极方程式.
(1)负极材料:A池
(2)电极反应式:A池:正极
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)在原电池中易失电子的电极作负极、易得电子的电极作正极;
(2)A池中正极上氢离子得电子发生还原反应、负极上镁失电子发生氧化反应.
(2)A池中正极上氢离子得电子发生还原反应、负极上镁失电子发生氧化反应.
解答:
解:(1)A池中,镁比铝易失电子,所以Mg作负极、Al作正极;B池中,Mg和NaOH不反应,Al和NaOH溶液反应,所以Al作负极、Mg作正极,故答案为:Mg;Al;
(2)A池中正极上氢离子得电子发生还原反应、负极上镁失电子发生氧化反应,正极上电极反应式为2H++2e-=H2↑、负极上电极反应式为Mg-2e-=Mg2+,
故答案为:2H++2e-=H2↑;Mg-2e-=Mg2+.
(2)A池中正极上氢离子得电子发生还原反应、负极上镁失电子发生氧化反应,正极上电极反应式为2H++2e-=H2↑、负极上电极反应式为Mg-2e-=Mg2+,
故答案为:2H++2e-=H2↑;Mg-2e-=Mg2+.
点评:本题考查了原电池原理,明确正负极的判断方法是解本题关键,再结合各个电极上发生的反应来分析解答,注意不能根据金属的活泼性确定正负极,要根据失电子的难易程度确定正负极,为易错点.

练习册系列答案
相关题目
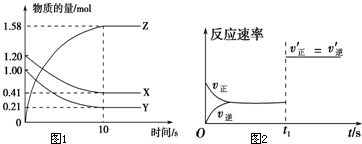 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示: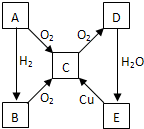 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.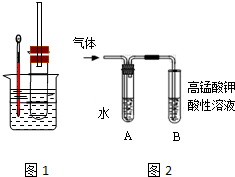 用图1实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
用图1实验装置(铁架台、酒精灯略) 验证溴乙烷的性质: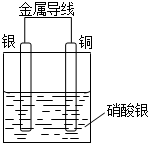 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.