题目内容
18.Na3N是离子化合物,它和水作用可产生NH3.下列叙述正确的是( )| A. | Na3N与盐酸反应生成的都是盐 | |
| B. | Na+和N3-的电子层结构不相同 | |
| C. | Na+的半径大于N3-的半径 | |
| D. | 在Na3N与水的反应中,Na3N做还原剂 |
分析 A.Na3N与足量盐酸作用,根据与水的反应生成氨气,可知生成氯化钠和氯化铵两种盐;
B.Na+和N3-离子核外电子数相同;
C.电子数相同的微粒,原子序数越大半径越小;
D.Na3N与水的反应为:Na3N+H2O=NaOH+NH3↑,非氧化还原反应.
解答 解:A.Na3N与盐酸反应Na3N+4HCl=3NaCl+NH4Cl,生成氯化钠和氯化铵,故A正确;
B.Na+和N3-离子核外电子数相同,而不是不同,故B错误;
C.Na+的半径小于N3-的半径,故C错误;
D.Na3N与水的反应为:Na3N+H2O=NaOH+NH3↑,非氧化还原反应,Na3N不是还原剂,故D错误;
故选A.
点评 本题考查了原子结构、离子半径大小的比较、氧化还原反应的判断等知识点,明确微粒的结构与水反应的原理是解题关键,难度不大,注意基础知识的总结.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
9.下列能够说明醋酸是弱酸的是( )
| A. | 醋酸能与水以任意比例混溶 | B. | 醋酸能与碳酸钠反应 | ||
| C. | 醋酸能使紫色石蕊试液变红色 | D. | 0.1mol.L-1醋酸溶液pH=3 |
6.下列化学用语表达不正确的是( )
| A. | 次氯酸的电子式: | |
| B. | 质子数为6、质量数为14的原子:${\;}_6^{14}N$ | |
| C. | CS2的结构式:S=C=S | |
| D. | 氯的原子结构示意图: |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2L氟化氢中含有分子的数目为0.5NA | |
| B. | 常温下a克某烷烃(CnH2n+2)中含有共用电子对数目为$\frac{a}{14n+2}$(3n+1)NA | |
| C. | 56g 聚乙烯中含有碳碳双键的数目为2NA | |
| D. | 常温下,0.2mol/L的FeCl3溶液中含Cl-数目为0.6NA |
10.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了提高汽油的产量和质量 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主要得到的是乙烯、丙烯等 |
7.下列有关合金的说法不正确的是( )
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 合金的熔点一般比其各成分金属的熔点低 | |
| C. | 铝钠合金投入到足量氯化铜溶液中,可能有铜析出 | |
| D. | mg不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则钠的质量分数越大 |
8.常温下可用铝制容器盛放的是( )
| A. | 浓硝酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 食用醋 |
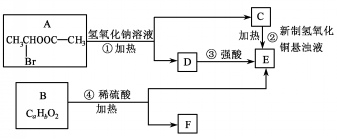
 .
.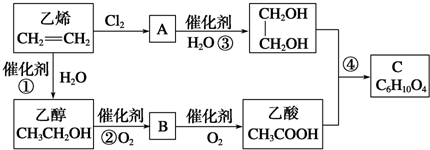
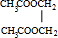 +2H2O.
+2H2O.