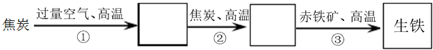
题目内容
8.常温下可用铝制容器盛放的是( )| A. | 浓硝酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 食用醋 |
分析 溶液可用铝制容器盛装,该溶液不能与Al反应或发生钝化现象.
解答 解:A、在常温下,浓硝酸具有“强氧化性”,可以在铝制器皿表明形成一层致密的氧化物薄膜,阻止酸和金属的继续接触,可以用铝制容器盛装浓硝酸,故A正确;
B、金属铝和稀硝酸反应,铝被腐蚀,不能用铝制容器盛装稀硝酸,故B错误;
C、铝与盐酸反应生成氯化铝与氢气,铝被腐蚀,不能用铝制容器盛装盐酸,故C错误;
D、食用醋主要成分为醋酸,铝与醋酸溶液反应,铝被腐蚀,不能用铝制容器盛装醋酸溶液,故D错误;
故选A.
点评 本题考查Al与硝酸等物质的性质,注意在常温下,浓硝酸和浓硫酸具有“强氧化性”,可以在铁或者铝表面形成一层致密的氧化物薄膜,阻止酸和金属的继续接触,发生钝化,题目难度不大.

练习册系列答案
相关题目
18.Na3N是离子化合物,它和水作用可产生NH3.下列叙述正确的是( )
| A. | Na3N与盐酸反应生成的都是盐 | |
| B. | Na+和N3-的电子层结构不相同 | |
| C. | Na+的半径大于N3-的半径 | |
| D. | 在Na3N与水的反应中,Na3N做还原剂 |
16.试推测第 82 号元素 X 的单质及其化合物不可能具有的性质( )
| A. | X 的氧化物的水化物可能有两种 | B. | .单质是能导电的固体 | ||
| C. | 单质不能与氢气直接化合 | D. | X 是非金属元素 |
3.目前世界上 60%的镁是从海水中提取的.学生就这个课题展开了讨论.已知海水提镁的主要步骤如图:
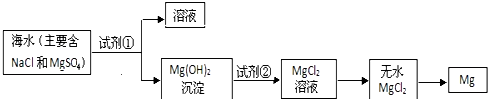
(一)在海水提镁的过程中如何实现对镁离子的富集?学生提出三个不同观点.
观点 1:直接往海水中加入沉淀剂.
观点 2:高温加热蒸发海水后,再加入沉淀剂.
观点 3:利用晒盐后的苦卤水,再加入沉淀剂.
请你评价三个学生提出的观点是否正确(填是或否),并简述理由.
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是Ca(OH)2(填化学式).
(2)加入的足量试剂②是HCl(填化学式).
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是c.
a.Mg(OH)2$\stackrel{△}{→}$MgO$→_{2800℃}^{电解}$Mg b.Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{C}{→}$Mg
c.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{714℃}^{电解}$Mg d.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{还原}^{活泼金属}$Mg.

(一)在海水提镁的过程中如何实现对镁离子的富集?学生提出三个不同观点.
观点 1:直接往海水中加入沉淀剂.
观点 2:高温加热蒸发海水后,再加入沉淀剂.
观点 3:利用晒盐后的苦卤水,再加入沉淀剂.
请你评价三个学生提出的观点是否正确(填是或否),并简述理由.
| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
(1)为了使镁离子沉淀下来,加入的足量试剂①是Ca(OH)2(填化学式).
(2)加入的足量试剂②是HCl(填化学式).
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是c.
a.Mg(OH)2$\stackrel{△}{→}$MgO$→_{2800℃}^{电解}$Mg b.Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{C}{→}$Mg
c.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{714℃}^{电解}$Mg d.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{还原}^{活泼金属}$Mg.
13.电解冶炼铝时使用了助熔剂Na3AlF6,在电解槽中存在电解质W2[X2Y2Z4],Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半.下列说法正确的是( )
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | W的最高价氢氧化物的碱性比X弱 | D. | Y的最简单氢化物的稳定性比Z的强 |
17.用CO合成甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.下列不能说明反应已达平衡状态的是( )
| A. | 单位时间内生成2mol H2的同时消耗了1mol CO | |
| B. | c(CO):c(CH3OH)=1:1 | |
| C. | 在恒温恒容的容器中,混合气体的压强保持不变 | |
| D. | 在绝热恒容的容器中,反应的平衡常数不再变化 |
12.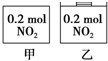 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |