题目内容
18.溴酸钾曾作为面粉的增白剂,自从发现溴酸钾是一种致癌物质,过量食用会损害人的中枢神经、血液和肾脏,现在已经停止使用.已知在酸性条件下.有以下转化关系:①KBrO3能将KI氧化成I2或KIO3其自身可被还原成Br一或Br2.②Br2能将I一氧化成I2.
③KIO3能将I一氧化成I2,也能将Br一氧化成Br2,其自身被还原成I2.
试回答下列问题:
(1)KBrO3、Br2、KIO3、I2氧化能力由弱到强的顺序为I2<Br2<KIO3<KBrO3.
(2)KBrO3具有漂白性是因为KBrO3具有强氧化性;
请写出两种与其漂白原理不相同的物质的名称二氧化硫、活性炭.
(3)向含有1mol KI的硫酸溶液中加入a mol的KBrO3溶液,a的取值不同,所得的产物也不同.开始滴加KBrO3溶液时发生的反应为:6KI+KBrO3+3H2SO4═3K2SO4+3I 2+KBr+3H2O当产物既有I2又有Br2时,反应的化学方程式为10KI+2KBrO3+6H2SO4=K2SO4+5I2+Br2+6H2O.
分析 (1)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性进行比较;
(2)具有强氧化性的物质能漂白,具有吸附性或能与有色物质反应生成无色物质的均能漂白;
(3)反应中I元素的化合价升高,Br元素的化合价降低,根据得失电子守恒和原子守恒配平方程式.
解答 解:(1)①KBrO3能把KI氧化成I2或KIO3,KBrO3本身被还原为Br2,则氧化性顺序是:KIO3<KBrO3,②Br2能把I-氧化为I2,氧化性是I2<Br2,
③KIO3能把I-氧化为I2,氧化性是:I2<KIO3,④KIO3能把Br-氧化为Br2,氧化性是:Br2<KIO3,综上氧化性顺序是:I2<Br2<KIO3<KBrO3,
故答案为:I2<Br2<KIO3<KBrO3;
(2)已知KBrO3具有强氧化性,具有强氧化性的物质能漂白;活性炭具有吸附性能漂白有色物质,二氧化硫能与有色物质反应生成无色物质,所以能漂白;
故答案为:KBrO3具有强氧化性;二氧化硫、活性炭;
(3)KI与KBrO3溶液反应生成I2、Br2,反应中I元素的化合价升高,Br元素的化合价降低,其反应的方程式为:10KI+2KBrO3+6H2SO4=K2SO4+5I2+Br2+6H2O;
故答案为:10KI+2KBrO3+6H2SO4=K2SO4+5I2+Br2+6H2O.
点评 本题考查了氧化还原反应,涉及氧化性强弱的判断以及电子守恒、元素守恒的应用等知识,注意知识的迁移和应用是关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.短周期主族元素X、Y、Z、W的原子序数依次递增,X的一种原子核内无中子,Y原子最外层电子数是内层电子总数的2倍,W原子最外层电子数是Y原子最外层电子数的1.5倍,Z、W同主族,下列说法正确的是( )
| A. | X与Y形成原子个数比1:1的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
3.一定量的盐酸跟少量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入( )
| A. | KNO3溶液 | B. | NaCl溶液 | C. | 铜粉 | D. | 硫酸铜晶体 |
7.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
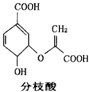

| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 1 mo1分枝酸最多可与3 mol NaOH发生中和反应 | |
| C. | 分枝酸的分子式为C10H8O6 | |
| D. | 分枝酸分子中含有2种官能团 |