题目内容
13.水的电离平衡曲线如图所示,下列说法中,正确的( )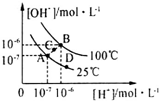
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3•H2O)的值逐渐减小 | |
| C. | 在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | 100℃时,0.05mol•L-1 H2SO4溶液的pH≠1 |
分析 A.A、D的温度相同,则水的离子积相同;
B.设氨水的电离平衡常数为kb,则c(NH4+)/c(NH3•H2O)=$\frac{{K}_{b}}{c(O{H}^{-})}$;
C.温度不变,加入氯化铵后水的离子积不变;
D.溶液的pH=-lgc(H+),根据氢离子浓度进行计算.
解答 解:A.温度升高,在水的离子积增大,B、D的温度相同,则水的离子积相同,所以图中A、B、D三点处Kw的大小关系:B>A=D,故A错误;
B.若氨水的电离平衡常数为kb,则c(NH4+)/c(NH3•H2O)=$\frac{{K}_{b}}{c(O{H}^{-})}$,随着氨水的加入,溶液中氢氧根离子浓度逐渐增大,则c(NH4+)/c(NH3•H2O)的值逐渐减小,故B正确;
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,该过程中水的离子积不变,则体系无法可从A点变化到C点,故C错误;
D.100℃时,0.05mol•L-1 H2SO4溶液中氢离子浓度为0.1mol/L,该硫酸溶液的pH=-lgc(H+)=1,故D错误;
故选B.
点评 本题考查了水的电离及其影响因素,题目难度不大,明确水的离子积与温度有关,与溶液酸碱性无关为解答关键,D为易错点,注意溶液pH的计算方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法正确的是( )
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
4.下列说法不正确的是( )
| A. | 在有机物中碳原子与其他原子最多形成4 个共价键 | |
| B. | 用溴的四氯化碳溶液既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| C. | 煤干馏后的煤焦油中含有苯、甲苯、二甲苯等有机物,可以通过萃取的方法将其提纯出来 | |
| D. | 用酸性高锰酸钾溶液可以鉴别己烷和甲苯 |
1.下列各组中物质相互反应时,无论哪种过量,都可以用同一个离子反应方程式表示的是( )
①碳酸钠溶液与盐酸
②偏铝酸钠溶液与盐酸
③氢氧化钠溶液与CO2
④硝酸银溶液与氨水
⑤氯化铝溶液与氨水.
①碳酸钠溶液与盐酸
②偏铝酸钠溶液与盐酸
③氢氧化钠溶液与CO2
④硝酸银溶液与氨水
⑤氯化铝溶液与氨水.
| A. | ③⑤ | B. | ①③ | C. | 仅有⑤ | D. | ②④ |
8.下列离子反应方程式正确的是( )
| A. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| B. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| C. | 往FeCl3溶液中通入H2S气体:2Fe3++H2S═2Fe2++S↓+2H+ | |
| D. | 大苏打溶液中加入稀硫酸:S2O32-+2SO42-+6H+═4 SO2↑+3H2O |
18.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 经常使用一次性筷子、纸杯、塑料袋等 | |
| D. | 改进汽车尾气净化技术,减少大气污染物的排放 |
2.短周期元素甲、乙、丙、丁的原子序数依次增大,甲原子核外有三种能量不同的电子.乙、丙和丁的原子核外均有一个未成对电子.甲、乙、丙最高价氧化物对应的水化物两两之间能相互反应.下列说法错误的是( )
| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
3.(1)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则:
①该温度下,水的离子积常数Kw=10-13.
②该温度下,100mL 0.1mol/L的稀硫酸溶液中由水电离的c(OH-)=5×10-13mol/L.
(2)实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体.用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-.某同学认为还可能存在其他离子,并提出假设进行实验探究.
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
①该温度下,水的离子积常数Kw=10-13.
②该温度下,100mL 0.1mol/L的稀硫酸溶液中由水电离的c(OH-)=5×10-13mol/L.
(2)实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体.用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-.某同学认为还可能存在其他离子,并提出假设进行实验探究.
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; | 现象:品红不褪色 结论:假设1不成立; |
| 步骤2:另取少量吸收液于试管中, 滴入几滴KSCN溶液. | 现象:溶液变红 结论:假设2成立. |