题目内容
6.下列事实中一定能证明HClO是弱电解质的是( )(1)pH相等的H2SO4和HClO与足量的强碱反应,HClO消耗的强碱体积大
(2)用HClO溶液做导电性实验,灯泡很暗
(3)NaClO溶液中有HClO分子存在
(4)HClO溶液有很强的氧化性
(5)等体积,等物质的量浓度的HClO与NaOH溶液恰好完全反应
(6)盐酸与KClO溶液反应生成HClO
(7)1mol/L的HClO溶液能使紫色石蕊试液先变红后褪色.
| A. | (1)(2)(3) | B. | (1)(3)(6) | C. | (1)(2)(5)(6) | D. | (1)(3)(6)(7) |
分析 常温下,部分电离的电解质是弱电解质,完全电离的电解质是强电解质,酸根离子能够水解的酸为弱酸,根据HClO的电离程度及次氯酸根能否水解判断该酸是否是弱电解质,以此解答该题.
解答 解:(1)pH相等的H2SO4和HClO与足量的强碱反应,HClO消耗的强碱体积大,说明HClO没有完全电离,是弱酸,故正确;
(2)溶液的导电性与离子的浓度有关,弱电解质的浓度大时导电实验中灯泡也很亮,没有对比实验,无法说明HClO是弱电解质,故错误;
(3)NaClO溶液中有HClO分子存在,说明次氯酸根发生了水解,HClO为弱酸,故正确;
(4)HClO溶液有很强的氧化性,氧化性强弱与酸性强弱没有必然联系,不能说明HClO是弱酸,故错误;
(5)等体积,等物质的量浓度的HClO与NaOH溶液恰好完全反应,只能说明HClO是一元酸,不能说明其酸性强弱,故错误;
(6)盐酸与KClO溶液反应,生成HClO,说明HClO的酸性比盐酸弱,是弱电解质,故正确;
(7)1mol/L的HClO溶液能使紫色石蕊试液先变红后褪色,只能说明HClO具有酸性和强氧化性,故错误.
故选B.
点评 本题考查强电解质强弱的判断,为高频考点,侧重于学生的分析能力的考查,明确强弱电解质的本质区别是解本题关键,注意不能根据电解质的溶解性强弱、溶液导电性强弱判断电解质强弱,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1 mol/L氯化铜溶液中的Cu2+数小于NA | |
| B. | 标准状况下,22.4 L Cl2与水反应转移的电子数为NA | |
| C. | 28 g聚乙烯含有的碳原子数为2NA | |
| D. | 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
17.25℃时,在等体积的下列溶液中,发生电离的水的物质的量之比是( )
①0.5mol•L-1的H2SO4溶液,②0.05mol•L-1的Ba(OH)2溶液,③1mol•L-1的NaCl溶液,④纯水.
①0.5mol•L-1的H2SO4溶液,②0.05mol•L-1的Ba(OH)2溶液,③1mol•L-1的NaCl溶液,④纯水.
| A. | 107:107:1:1 | B. | 1:10:107:107 | C. | 107:106:2:2 | D. | 107:106:2×107:2 |
14.能使湿润的淀粉KI试纸变蓝的是( )
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾.
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾.
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①③⑤ |
1.下列做法与社会可持续发展理念相违背的是( )
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用资源节约型、环境友好型的生物降解塑料包装袋 |
11.如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )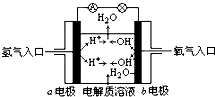

| A. | b电极是负极 | |
| B. | 总反应方程式为:2H2+O2═2H2O | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
8.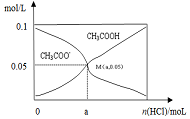 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,c(H+)-c(OH-)=(100a-5.0×10-2) mol/L | |
| C. | 随着HCl的通入,$\frac{c(O{H}^{-})}{c(C{H}_{2}CO{O}^{-})}$值不断减小 | |
| D. | 当n(HCl)=1.0×10-3mol时,溶液中c(Na+)>c(Cl-)>c(CHCOO-)>c(H+)>c(OH-) |
9.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 71 g Cl2所含原子数为2NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |