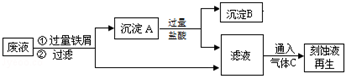
题目内容
2. 实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:
实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:CH3CH2OH+H2SO4(浓)$\stackrel{100℃}{?}$ CH3CH2OSO2OH+H2O ①
CH3CH2OSO2OH(浓)$\stackrel{170℃-15℃}{?}$ CH2═CH2+H2SO4 ②
(1)浓硫酸在乙烯生成中作用为催化作用,反应①属于取代(酯化)反应,反应②属于消去反应.
(2)此法在实际操作中由于浓H2SO4的用量大、比热容高,加热至170℃所需时间长,有人将乙醇和浓H2SO4的混合液加热到80℃时,一次性投入一些小碎块的生石灰,大大缩短了反应所需时间,提高了乙烯的产率,试用速率和平衡理论解释之CaO与水反应放热体系温度升高,加快反应速率,CaO与H2O反应使H2O量减小促使可逆反应(1)向右移动,CaO与浓H2SO4也反应但反应很快,生石灰与水反应占主导地位.
(3)反应过程中乙醇常被炭化,使溶液有黑色物质出现,随着反应进行炭化现象越来越严重,同时还可使制得的乙烯气体中含有CO2、SO2等气体,为了减少反应过程中炭化现象又不影响乙烯的生成,下列措施合理的是B、C、E.
A.调整乙醇和浓硫酸的体积比为1:4
B.调整乙醇和浓硫酸的体积比为1:2
C.用大理石代替碎瓷片
D.降低反应体系温度至140℃
E.用其他脱水剂(如P2O5)代替浓硫酸
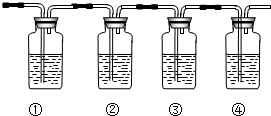
(4)如图为有人设计确认混合气体中含有乙烯和二氧化硫的实验装置图.(下列试剂可供选择:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾)
A①②③④中可盛放的试剂分别为①品红;②NaOH溶液;③品红溶液;④Br2或酸性KMnO4;
B能说明二氧化硫气体存在的现象是装置①中品红褪色.
C能确认含有乙烯的现象是装置③中品红不褪色,装置④中溶液褪色.
分析 (1)对比反应①、②可知反应中硫酸起到催化剂的作用,结合官能团的变化判断反应类型;
(2)CaO可与水反应,且反应放热,可加快反应速率且使pH正向移动;
(3)浓硫酸具有脱水性,为减少反应过程中炭化现象又不影响乙烯的生成,不能改变反应温度,可降低硫酸的使用量或用其它替代品;
(4)制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,利用二氧化硫具有漂白性,乙烯可以使溴水或高锰酸钾溶液褪色,但检验乙烯前,需要把二氧化硫全部除去,一般用氢氧化钠溶液吸收,吸收后用品红溶液检验是否除净;试剂选择为品红试液检验二氧化硫存在、氢氧化钠溶液吸收二氧化硫、品红试液检验二氧化硫是否除净、溴水或高锰酸钾溶液褪色检验乙烯的存在.
解答 解:(1)对比反应①、②可知反应中硫酸起到催化剂的作用,反应①属于取代反应或酯化反应,反应②属于消去反应,
故答案为:催化作用;取代(酯化);消去;
(2)加入氧化钙,CaO与水反应放热体系温度升高,加快反应速率,CaO与H2O反应使H2O量减小促使可逆反应(1)向右移动,CaO与浓H2SO4也反应但反应很快,生石灰与水反应占主导地位,
故答案为:CaO与水反应放热体系温度升高,加快反应速率,CaO与H2O反应使H2O量减小促使可逆反应(1)向右移动,CaO与浓H2SO4也反应但反应很快,生石灰与水反应占主导地位;
(3)浓硫酸具有脱水性,为减少反应过程中炭化现象又不影响乙烯的生成,不能改变反应温度,可降低硫酸的使用量或用其它替代品,则B、C、E正确,
故答案为:B、C、E;
(4)制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,利用二氧化硫具有漂白性,乙烯可以使溴水或高锰酸钾溶液褪色,但检验乙烯前,需要把二氧化硫全部除去,一般用氢氧化钠溶液吸收,吸收后用品红溶液检验是否除净;试剂选择为品红试液检验二氧化硫存在、氢氧化钠溶液吸收二氧化硫、品红试液检验二氧化硫是否除净、溴水高锰酸钾溶液褪色检验乙烯的存在,
A.由以上分析可知①为品红;②为NaOH溶液;③为品红溶液;④为Br2或酸性KMnO4,
故答案为:品红;NaOH溶液;品红溶液;Br2或酸性KMnO4;
B.能说明二氧化硫气体存在的现象是装置①中品红褪色,故答案为:装置①中品红褪色;
C.能确认含有乙烯的现象是装置③中品红不褪色,装置④中高锰酸钾溶液褪色,故答案为:装置③中品红不褪色,装置④中溶液褪色.
点评 本题考查物质的制备以及性质实验,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,题目侧重考查考查实验室制取乙烯方法,难度不大,关键是把握住实验室制取乙烯的原理,对于仪器及试剂使用的目的清楚.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
下列叙述正确的是( )
| A. | 该反应的热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 曲线b表明加入催化剂降低了反应热,加快了反应速率 | |
| C. | 加入催化剂,生成1molNH3的反应热减小50KJ | |
| D. | 不用催化剂,生成1molNH3放出的热量为46KJ |
| A. | 煤的干馏是化学变化 | |
| B. | 煤液化后可以得到甲醇等液体燃料 | |
| C. | 煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来 | |
| D. | 从萃取分液后溴的四氯化碳溶液中提取溴可以用蒸馏的方法 |
(1)将氯化铝水溶液加热蒸干并灼烧得到的固体产物是Al2O3.
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如图:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3[来 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质的反应方程式是Fe2O3+3C$\frac{\underline{\;950℃\;}}{\;}$2Fe+3CO↑.
③已知:
Al2O3(s)+3C(s)═2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
2AlCl3(g)═2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=+174.9kJ/mol.
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为NaCl、NaClO、Na2CO3⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是除去FeCl3,提高AlCl3纯度.
⑥在Ⅰ至Ⅴ中涉及到氧化还原反应的有Ⅰ、Ⅱ、Ⅴ.
| A. | C5H12属于烷烃且有2种同分异构体 | |
| B. | 乙烯、氯乙烯、甲苯分子中的所有原子均共平面 | |
| C. | C4H10与Cl2在光照条件下反应,可生成4种一氯代烃 | |
| D. | 苯分子中不含碳碳双键,所以不能发生加成反应 |

 .
. .
.
 或
或 .
. .
. (写出四者之一即可).
(写出四者之一即可).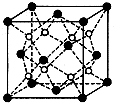 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则: