题目内容
2.按要求回答下列问题:(1)天然气主要成分是甲烷,甲烷燃烧放出热量多,3mol甲烷燃烧时,生成液态水和二氧化碳气体,同时放出2670.9kJ的热量,写出反应热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,把甲烷燃烧设计成原电池能量利用率更高,该燃料电池中,使用铂作电极,KOH溶液做电解质溶液.通入甲烷燃气的一极为负极,该极上的电极反应式为CH4+10OH--8e-=CO32-+7H2O
(2)已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O;加水稀释,溶液变黄色,试从浓度商与平衡常数关系解释原因加水稀释Q=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-}){c}^{2}({H}^{+})}$>K,平衡逆向移动
(3)判断:①SiC,②CO2,③Br2,④KCl晶体的熔点由高到低排列的顺序:①④③②(序号)
(4)在密闭容器中,加入一定量的A和B,反应到达平衡.能说明反应2A(l)+B(g)?C(l)+2D(l)达平衡状态的是BC
A.v(A)=2v(B)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变.
分析 (1)3mol甲烷燃烧时,生成液态水和二氧化碳气体,同时放出2670.9kJ的热量,所以1mol放出热量为:$\frac{2670.9kJ}{3}$=890.3kJ;燃料作为原电池的负极,电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
(2)加水稀释,向离子浓度大的方向移动;加水稀释Q=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-}){c}^{2}({H}^{+})}$>K,平衡逆向移动;
(3)一般说来原子晶体的熔点大于离子晶体,离子晶体大于分子晶体,结合常温下的状态判断二氧化碳和溴的熔点;
(4)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断.
解答 解:(1)3mol甲烷燃烧时,生成液态水和二氧化碳气体,同时放出2670.9kJ的热量,所以1mol放出热量为:$\frac{2670.9kJ}{3}$=890.3kJ,所以热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;通入甲烷燃气的一极为负极,电极反应式为CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;负极;CH4+10OH--8e-=CO32-+7H2O;
(2)加水稀释,向离子浓度大的方向移动,所以平衡逆向移动,颜色变黄色;加水稀释Q=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-}){c}^{2}({H}^{+})}$>K,平衡逆向移动,故答案为:黄;加水稀释Q=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-}){c}^{2}({H}^{+})}$>K,平衡逆向移动;
(3)SiC是原子晶体,其熔点大于KCl,二氧化碳和溴都是分子晶体,其熔点低于KCl,常温下二氧化碳是气体,溴为液态,所以其熔点由高到低的顺序为①④③②,
故答案为:①④③②;
(4)A、v(A)=2v(B)只能看出反应速率之比等于化学计量数之比,不能确定正逆反应速率相等,故A错误;
B、反应物和生成物中只有B为气态,压强不变说明B的浓度不变,反应达到平衡状态,故B正确;
C、反应物和生成物中只有B为气态,恒容条件下密度不变,说明B的质量不变,反应达到平衡状态,故C正确;
D、反应物和生成物中只有B为气态,其摩尔质量始终不变,故D错误;
故答案为:BC.
点评 本题考查较为综合,考查了热化学方程式书写、电极反应式书写、平衡移动、不同晶体熔点大小的比较、化学平衡状态的判断,题目难度较大.

| A. | 0.1mol•L-1硫化钠溶液中离子浓度关系:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)] | |
| B. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| C. | 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 0.1mol•L-1的氯化铵溶液与0.05mol•L-1的氢氧化钠溶液等体积混合后,混合溶液中离子浓度:c(Cl-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) |
| A. | 在饱和硫酸铜溶液中放入胆矾晶体,几天后晶体外形发生改变且晶体质量变小 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液和1mol?L-1CuCl2溶液中,铝片表面都观察不到明显的反应现象 | |
| C. | 可用紫外可见分光光度法来测定溶液中苯酚的含量 | |
| D. | 在比较乙醇和苯酚与钠反应的实验中,要把乙醇和苯酚配成同物质的量浓度的水溶液,再与相同大小的金属钠反应,来判断两者羟基上氢的活性大小 |
| A. | 6.4 | B. | 8 | C. | 3.2 | D. | 9.6 |
| A. | 过滤时将液体沿着玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| B. | 蒸馏时烧瓶需要垫石棉网 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 冷凝管的进水方向是低进高出 |
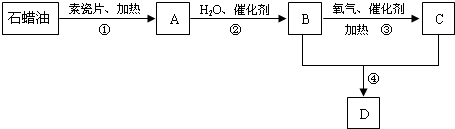
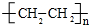 .
.